Definición
El cáncer cervicouterino es la neoplasia maligna que se origina, por lo general en la unión escamo columnar del cuello uterino, normalmente se encuentra asociado a la infección por virus del papiloma humano (VPH).
Epidemiología y Factores de riesgo
El cáncer cervicouterino ocupa el tercer lugar de los tumores malignos que sufren las mujeres en todo el mundo. Se estima que cada año aparecen cerca de 530232 nuevos casos.
En México, el cáncer cervicouterino fue la primera causa de muerte por tumores malignos en la mujer hasta el año 2005.La incidencia estimada de cáncer cervicouterino para el año 2008, en México, fue de 19.2 por cada 100 000 mujeres de todas las edades.
La edad promedio al momento del diagnóstico es entre los 47 y 51 años de edad,el cáncer in situ alrededor de los 40 años y en el cáncer invasor alrededor de los 50 años. La Secretaría de Salud de México, reporta que la edad promedio en que se detecta la displasia cervical leve está entre 25 y 30 años; displasia moderada entre 30 y 35 años; displasia grave o carcinoma in situ 40 y 50 años. El cáncer microinvasor 45 y 50 años, y el invasor de los 50 años en adelante.
En el Hospital General de México, la edad a que se diagnostica el cáncer in situ está entre 41 y 43.9 años; estadio I entre 45 y 47 años; el II a los 50años; el III entre 52 y 53 años; y el IV entre 52 y 58 años. Las mayores tasas de mortalidad se registran después de los 65 años.
El cáncer cervicouterino sigue siendo una enfermedad de la pobreza, su frecuencia y mortalidad más altas ocurren en los estados del sur de México, particularmente en área rural, donde se ha cuantificado un riesgo dos veces mayor de mortalidad en comparación con áreas urbanas.
El cáncer cervicouterino afecta principalmente a las mujeres de medio socioeconómico bajo y a los factores que con esto se relacionan como baja escolaridad, desempleo, residencia en áreas rurales y la falta de acceso a los servicios de salud.
Los factores de riesgo, que se han documentado para cáncer cervicouterino son: baja escolaridad, bajo nivel socioeconómico, tabaquismo, antecedentes de enfermedades de transmisión sexual, inicio de vida sexual temprana, múltiples parejas sexuales, multiparidad y uso de anticonceptivos orales. Se ha mencionado que existen otros determinantes de progresión a cáncer cervicouterino, entre estos se incluye: tipo viral oncogénico, persistencia de la infección, carga viral por unidad celular, factores genéticos, el sistema inmune del paciente, virus de inmunodeficiencia humano (VIH), otras enfermedades asociadas y medicamentos que causen inmunosupresión que favorezcan su degeneración.
•Comportamiento sexual: El inicio de la vida sexual a una edad temprana se ha asociado a incremento en el riesgo de hasta 10 veces. Se ha postulado que antes de los 16 años la zona de transformación es más susceptible de infectarse por el virus del papiloma humano con lo que aumenta el riesgo de desarrollar cáncer cervicouterino invasor. Otros factores no menos importantes incluyen: múltiples parejas sexuales, tanto de la mujer como de su pareja, las relaciones sexuales con prostitutas, el cáncer de pene y el antecedente de verrugas genitales.
•Uso de anticonceptivos orales: Este factor es algo controversial, sin embargo en algunos estudios se ha determinado que es un factor de riesgo independiente de la actividad sexual.
•Historia reproductiva: En un estudio realizado en el Instituto Nacional de Cancerología se encuentra un riesgo incrementado en las multíparas de hasta 6.5 veces en relación con las nulíparas.
•Tabaquismo: Se ha detectado productos relacionados con el tabaco en el moco cervical los cuales afectan mediante dos mecanismos, disminuyendo la inmunidad local por afección de la actividad de las células presentadoras de antígeno tipo Langerhans y por efecto carcinógeno directo de los productos del tabaco principalmente las nitrosaminas.
•Factores nutricionales: Las deficiencias de Vitamina A, C y E, así como la desnutrición se han asociado a una inmunidad no competente lo cual puede favorecer la infección por virus del papiloma humano.
•Inmunosupresión: La alteración en el sistema inmune se ha asociado a un incremento en el riesgo de padecer cáncer cervicouterino invasor. Esta relación es evidente en las pacientes con VIH las cuales presenta un aumento en la incidencia de lesiones preinvasoras e invasoras. De igual manera, se ha observado un aumento en la incidencia de estas lesiones en pacientes inmunosuprimidas que recibieron trasplante renal y en pacientes con enfermedades de la colágena y leucemia.
Etiopatogenia
La identificación del virus de papiloma humano como la causa principal y necesaria del cáncer cervicouterino y el consecuente desarrollo de pruebas moleculares y de vacunas profilácticas para la detección y prevención de esta infección abrieron nuevas perspectivas para la prevención y el control del cáncer cervicouterino. Se ha descrito que la fracción atribuible al VPH en cáncer cervicouterino es cercana al 100% y en la actualidad se reconoce su atribución con los cánceres anogenitales, incluidos el ano, la vulva, la vagina y el pene. También se atribuye su participación en cánceres de cabeza y cuello, particularmente en cáncer orofaríngeo. Cerca del 80% de las mujeres jóvenes que contraen VPH presentan infecciones transitorias que se resuelven en el espacio de 12 a 18 meses en la mayoría de los casos vuelven a la normalidad en plazos relativamente cortos o no progresan a formas más graves.En cambio, es mucho más probable que la NIC de alto grado se convierta en cáncer invasor, aunque también algunas de estas lesiones persisten como tales o retroceden. El intervalo medio para que los precursores progresen a cáncer invasor va de 10 a 20 años. La probabilidad acumulada para todos los grados de NIC estudiados tanto por citología como por histología es de 45% de regresión, 31% de persistencia y 23% de progresión. Las tasas de progresión a cáncer invasor en estudios de seguimiento por biopsia de pacientes con carcinoma in situ se situaban entre 29% y 36%.9
El mecanismo de infección por el VPH ha sido bien estudiado en estos últimos años. El virus entra en el epitelio cervical a través de microlaceraciones que ocurren frecuentemente durante el coito. En el cuello uterino, el tejido metaplásico relativamente delgado es más susceptible a la infección vírica, que el epitelio epidermoide que es más grueso y maduro. Las cuatro fases principales del desarrollo del cáncer cervical son: a) infección del epitelio metaplásico de la zona de transformación por uno o más tipos carcinógenos de VPH; b) persistencia del virus; c) progresión clonal del epitelio infectado de forma persistente hasta el precáncer cervical (NIC 3) y d) invasión. Existen otros factores importantes en la infección por virus del papiloma humano y el desarrollo de cáncer cervical como lo son la actividad sexual, el género femenino y el inicio de vida sexual a edad temprana. Existe la asociación de cofactores que participan en la carcinogénesis del tracto genital inferior y cervical como lo son el tabaco, la infección por otros agentes microbianos, las deficiencias vitamínicas especificas, las influencias hormonales y las inmunodeficiencias. Se ha demostrado que existe un riego mayor de desarrollar una lesión intraepitelial escamosa de alto grado en mujeres positivas al VPH de alto riesgo que fuman o que son fumadoras pasivas. El consumo de tabaco influye en la inmunidad epitelial y reduce la cantidad de células de Langerhans presentadoras de antígenos presentes en el epitelio cervical. El abandono del tabaco favorece a la resolución de lesiones asociadas al VPH seguramente debido a la mejora de la inmunidad celular. La infección por el VPH genital y la neoplasia cervical son más frecuentes en aquellas mujeres que han tenido múltiples parejas sexuales o cuyo compañero ha tenido múltiples compañeras sexuales. La alteración de la integridad epitelial y de la metaplasia reparadora asociada a cervicitis aguda debido a Chlamydia trachomatis, Neisseria gonorrhoaea, virus del herpes simple o Trichomonas vaginalispodría incrementar la susceptibilidad a la infección por el VPH genital. Se ha demostrado un aumento de la NIC en las usuarias de anticonceptivos orales. La deficiencia de acido fólico, inducida por los anticonceptivos orales, junto con la reducción del metabolismo de mutagenos, es un mecanismo propuesto para explicar el incremento del riesgo. En mujeres embarazadas se ha visto un aumento en el número y tamaño de los condilomas acuminados debido seguramente al estado de los estrógenos en la maternidad que facilita la replicación del VPH. La deficiencia de vitamina A o β-carotenos en la dieta podría incrementar el riesgo de NIC y cáncer cervical.
El virus de papiloma humano infecta a las células basales, se despoja de su cápside y permanece en el núcleo del huésped separado de su genoma en un estado episomal. Al inicio solo hay replicación local e infección de las células basales vecinas. Puede permanecer en forma latente durante meses o años sin proliferar o expresarse morfológicamente. El material episomal se replica cada vez que la célula se divide, pero no prolifera posteriormente. Cuando existe una supresión del sistema inmune puede estimularse la replicación vírica y la proliferación más allá de la capa basal. A medida que las células epiteliales maduran, migran fuera de la membrana basal hacia la superficie. Al llegar a la capa intermedia el material genético empieza a encapsularse, replicar y proliferar dentro de la célula. Las células intermedias y superficiales tendrán muchos viriones por célula. Morfológicamente las células desarrollaran coilocitos (núcleos alargados, irregulares con un halo perinuclear), el efecto citopático del virus. Para la mayoría de las lesiones de bajo grado esta será su máxima expresión de una infección por VPH, y los efectos citopáticos nunca darán lugar a un verdadero proceso invasivo. La infección por el virus de papiloma humano se puede clasificar en: primero una infección latente, que se caracteriza por la presencia de VPH en las células o tejidos que son aparentemente normales y sin ninguna manifestación de enfermedad. Sin embargo el virus está ahí y en ocasiones puede ser detectado por técnicas específicas como Hibridación in situ o reacción en cadena de la polimerasa (PCR). Posteriormente la infección subclínica se manifiesta por cambios microscópicos en el epitelio cervical (detectados en las citologías o cortes histológicos de los tejidos afectados. La presencia de VPH en este punto se puede verificar mediante el uso de un colposcopio que evidencia cambios de coloración en el cuello uterino después de aplicar una solución de acido acético; estos cambios se asocian a la infección con VPH y una posible lesión premaligna. Finalmente la infección clínica se manifiesta por la aparición de tumores visibles, en esta etapa podemos encontrar gran cantidad de tejido positivo para VPH. Estos virus se encuentran viables y con capacidad de infectar otros tejidos. Sin embargo, no siempre la enfermedad se manifiesta durante esta última etapa ya que varios casos llegan a permanecer en periodo de latencia o subclínico, tiempo durante el cual se puede adquirir un estado de persistencia o regresión de las lesiones, en el peor de los casos de progresión hacia un cáncer invasor.
Patología
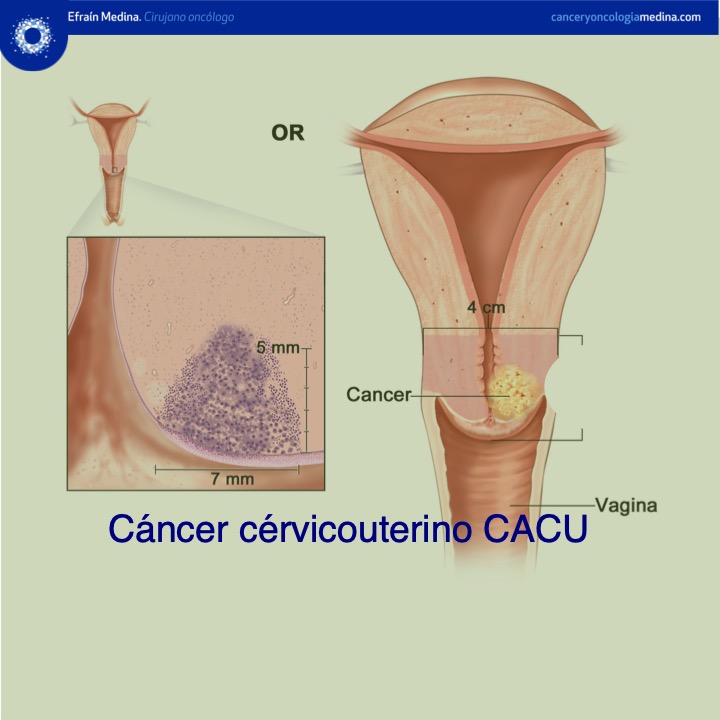
La historia natural de la enfermedad comienza con la infección del virus del papiloma humano, sin embargo debe quedar claro que la infección por sí sola, no es suficiente para inducir carcinoma en una paciente inmunocompetente. La infección por un virus de tipo oncogénico (alto riesgo) más la presencia de cofactores en el proceso de la enfermedad (factores de riesgo) pueden condicionar la carcinogénesis cervical. Dicho proceso inicia con la presencia de células atípicas en el epitelio cervical lo cual es conocido como displasia. Las lesiones displásicas pueden ser leves, moderadas o severas las cuales son consideras precursoras del carcinoma in situ y del carcinoma invasor. Estas lesiones son también llamadas neoplasia intraepitelial cervical (NIC I, NIC II o NIC III). Es importante mencionar que no todas las lesiones displásicas evolucionaran a cáncer, las lesiones con displasia leve tiene una mayor probabilidad de regresar espontáneamente que las lesiones con displasia severa. Así las lesiones NIC I solo progresaran a cáncer invasor en un 1%, mientras que las lesiones NIC III lo harán en más del 15% (Figura 1). Una vez que dicha lesión ha traspasado la membrana basal es considerada como carcinoma invasor.
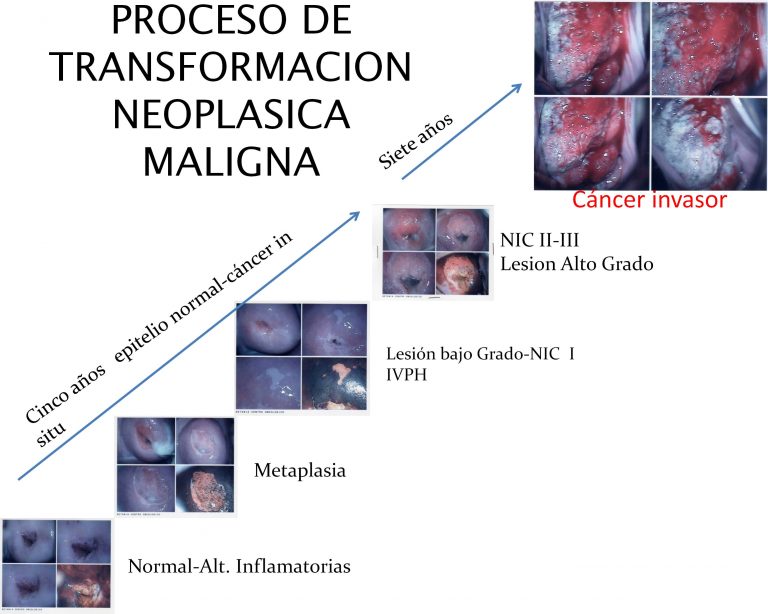
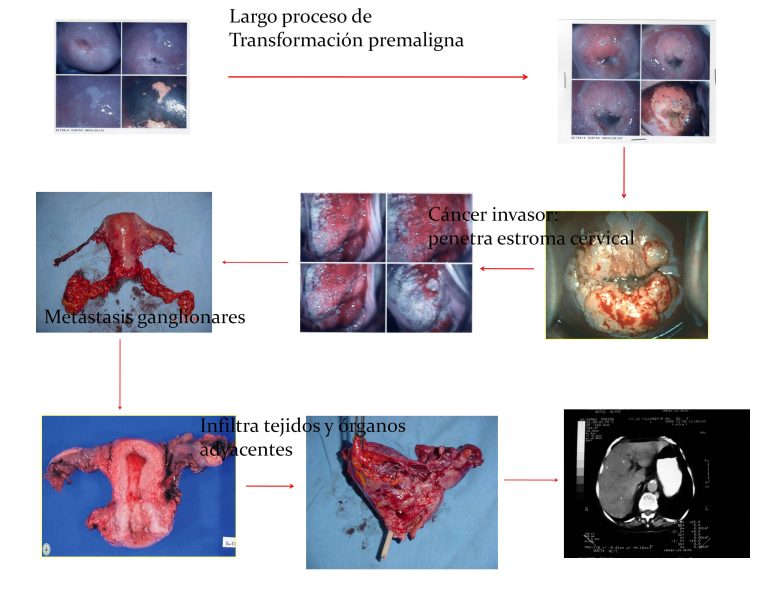
El cáncer cervicouterino, se disemina por vía linfática por los parametrios y ligamentos cardionales y uterosacros, afectando los ganglios en el siguiente orden: parametriales, obturadores, ganglios de la ilíaca interna (hipogástrica), ilíaca externa, ilíaca común, del sacro y ganglios presacrales.
Los sitios más comunes de metástasis (por vía hematógena) a distancia incluyen: ganglios paraórticos, mediastino, pulmón, cavidad peritoneal y hueso. Los ganglios supraclaviculares al momento del diagnóstico se considera metástasis a distancia (Figura 5.2).
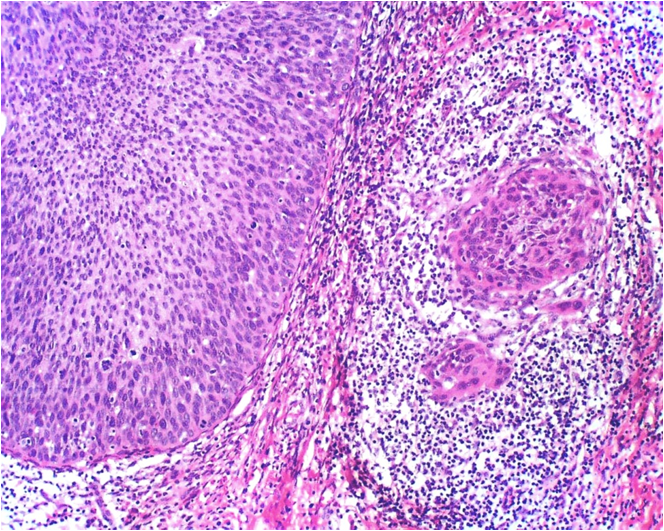
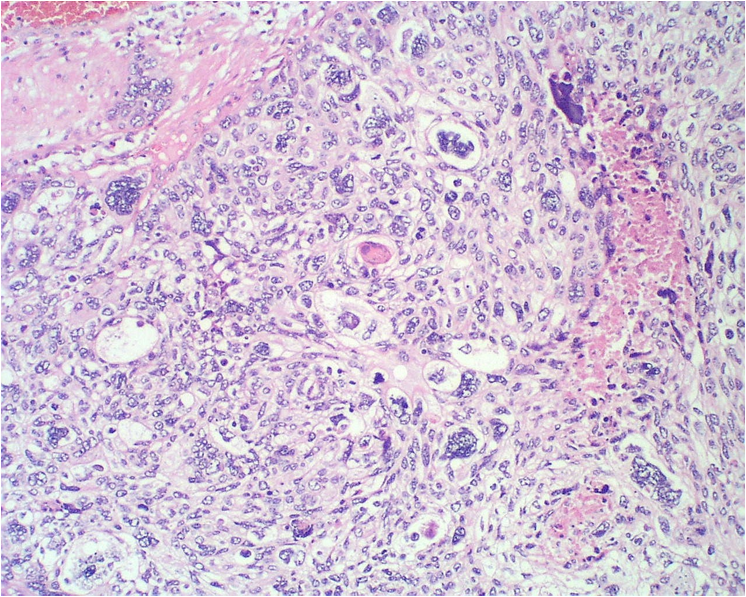
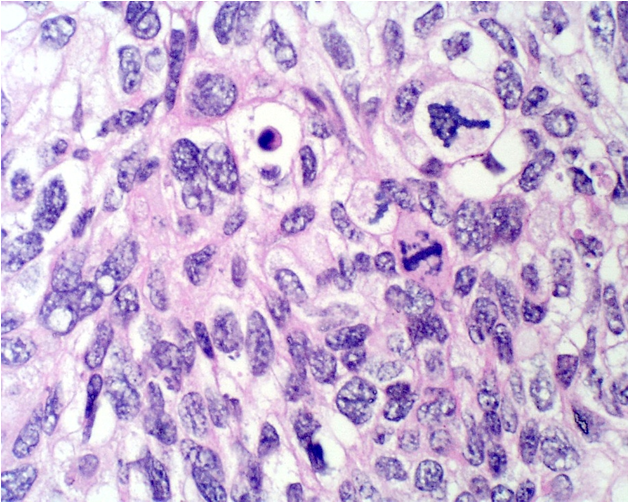
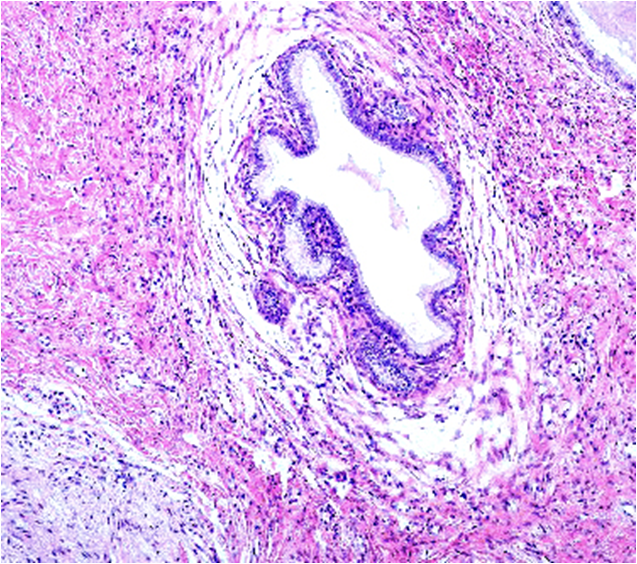
Desde el punto de vista histológico entre el 80% y el 90% de los carcinomas son de tipo epidermoide, asociado principalmente al VPH 16 (Figura 5.3 a Figura 7); mientras que el 10% al 15% son diagnosticados como adenocarcinoma (Figura.8 a Figura 11). que se asocia principalmente al VPH 18. Otros tipos menos frecuentes son el carcinoma adenoescamoso, el carcinoma adenoideo quístico y el carcinoma de células claras.
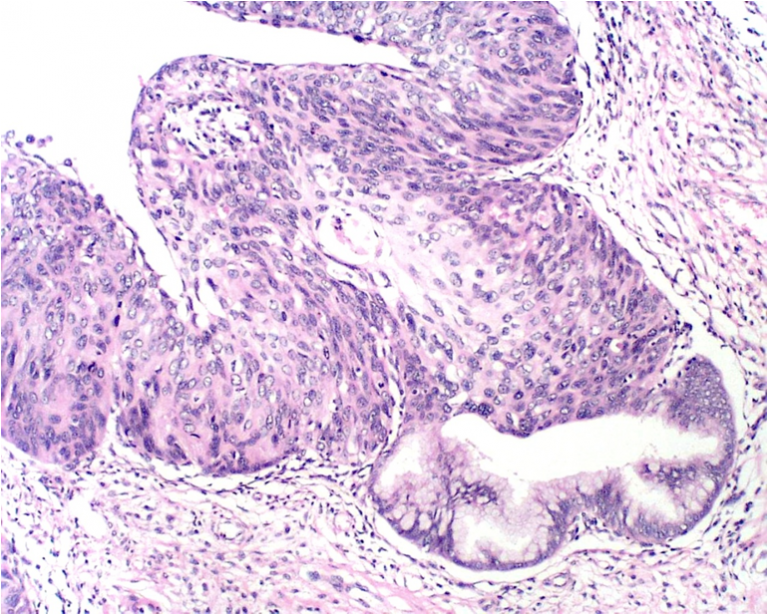

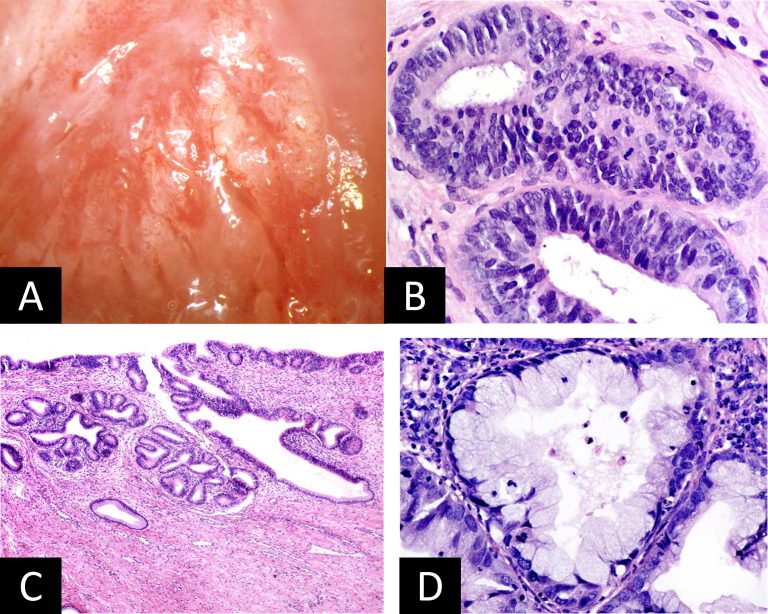
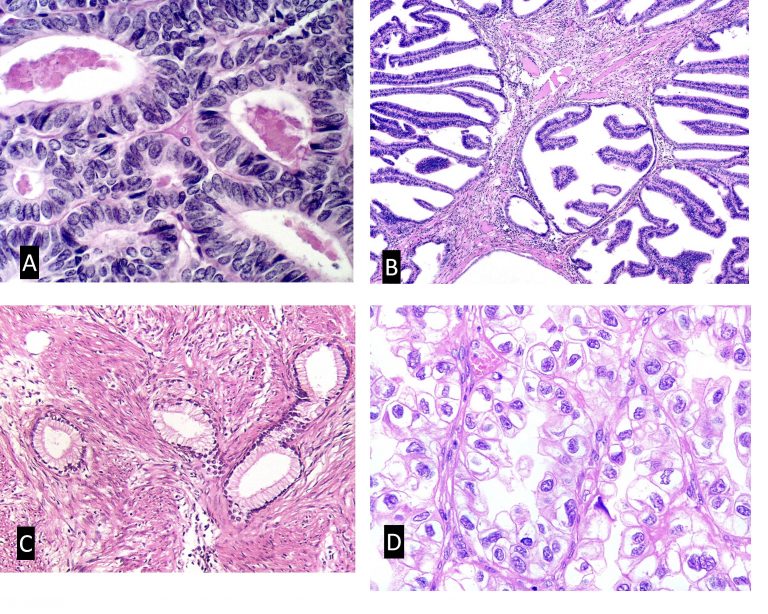
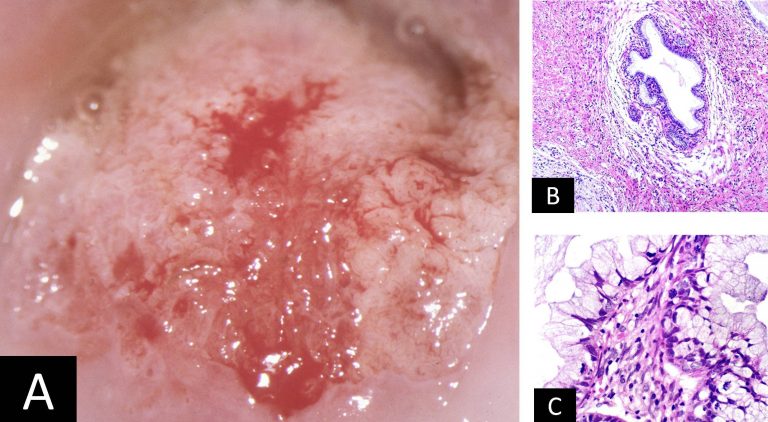
A. Colposcopia adenocarcinoma in situ.
B. Microfotografía adenocarcinoma in situ. Epitelio glandular con estratificación ,disminución de la mucoproducción e intensa actividad mitósica. (H-E).
C. Microfotografía adenocarcinoma in situ. Proliferación glandular compleja limitada a la porción superficial del epitelio. (H-E).
D.Microfotografía adenocarcinoma de tipo intestinal. Presencia de células caliciformes en las glándulas neoplásicas. (H-E).
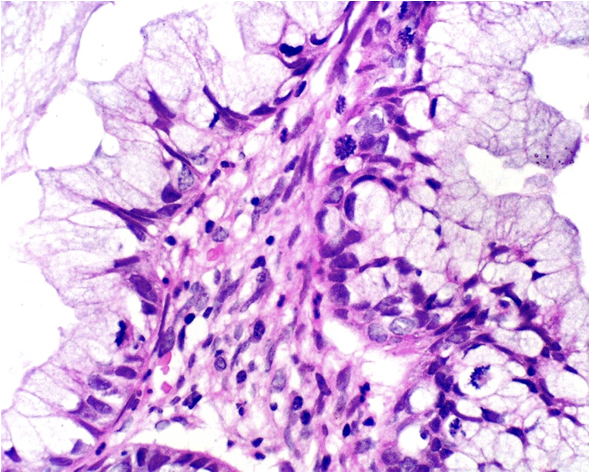
A.Adenocarcinoma de tipo endometrioide. Glándulas con estratificación y actividad mitósica sin mucoproducción. (H-E).
B.Adenocarcinoma de tipo villoglandular. Tumor constituido por papilas digitiformes revestidas por células neoplásicas seudoestratificadas con leve atipia nuclear. (H-E).
C.Adenoma maligno.Glándulas endocervicales con invasión profunda al estroma cervical con mínima atipia y reacción desmoplásica del estroma. (H-E).
D. . Adenocarcinoma de células claras. Tumor constituido por estructuras papilares y glandulares revestidas por células con aspecto en tachuela y presencia de secreciones eosinófilas densas. (H-E).
Cuadro clínico
Las lesiones preinvasoras y las lesiones invasoras en etapa inicial normalmente son asintomáticas (Figura 12).La forma más temprana del carcinoma invasor se reconoce histológicamente como carcinoma microinvasor. Son cánceres que no han invadido mas allá de 5 mm de profundidad y 7 mm de ancho hacia el estroma cervical subyacente, en esta fase temprana de invasión, el carcinoma cervicouterino puede no causar síntomas ni manifestaciones clínicas y, por consiguiente, se le conoce como carcinoma invasor preclínico (Figura 13).
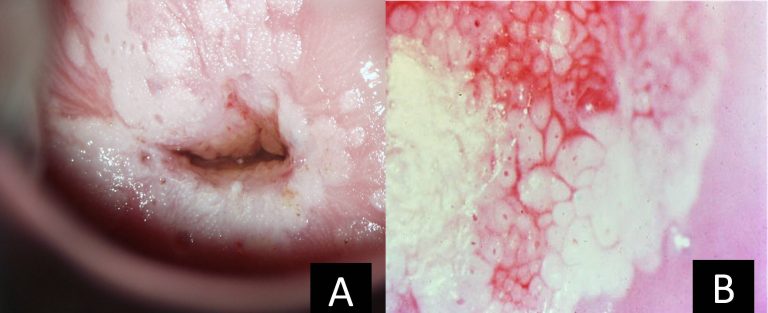
Cuando la paciente presenta algún síntoma, presentan leucorrea de larga evolución que no responde al tratamiento habitual. Las mujeres con cáncer invasor del cuello uterino a menudo tienen como manifestación inicial alguno o varios de los siguientes síntomas: hemorragias intermenstruales, hemorragias poscoitales, menstruaciones más abundantes, fluido transvaginal seropurulento abundante, fétido (de larga evolución y que no responde al tratamiento médico), cistitis recurrente, frecuencia y urgencia miccional, dolor de espalda y en la parte inferior del abdomen. El síntoma clásico del carcinoma invasor es el sangrado intermenstrual en una mujer premenopáusica. En pacientes activas sexualmente es común que refieran sangrado postcoital, que en ocasiones se asocia a dispareunia. Los tumores de gran tamaño pueden infectarse con facilidad y presentan descarga vaginal fétida asociada a sangrado transvaginal.
Los carcinomas invasores en estadios tempranos aparecen como un diminuto botón de células invasoras que han penetrado a través de la membrana basal hasta llegar al estroma subyacente. (Figura 14 a Figura 17).
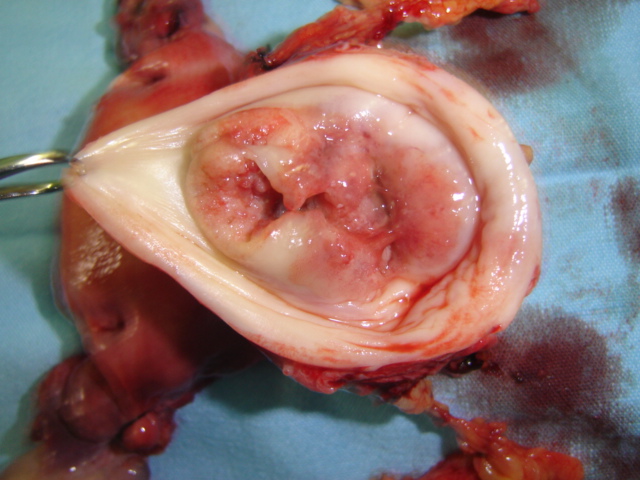

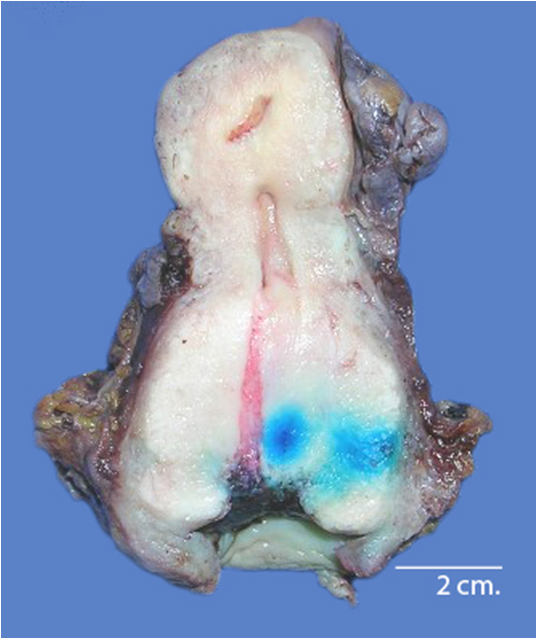
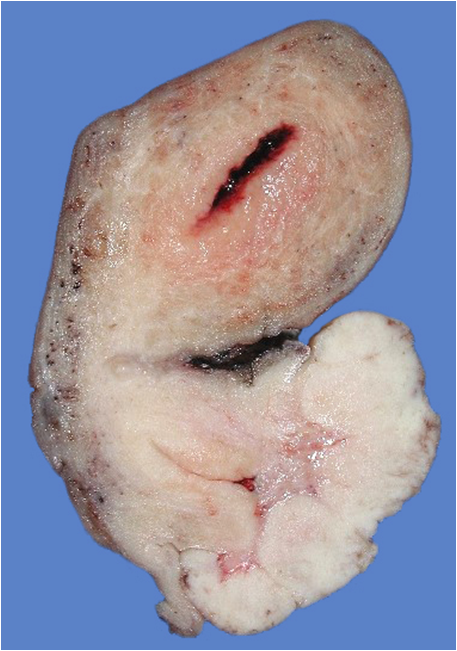
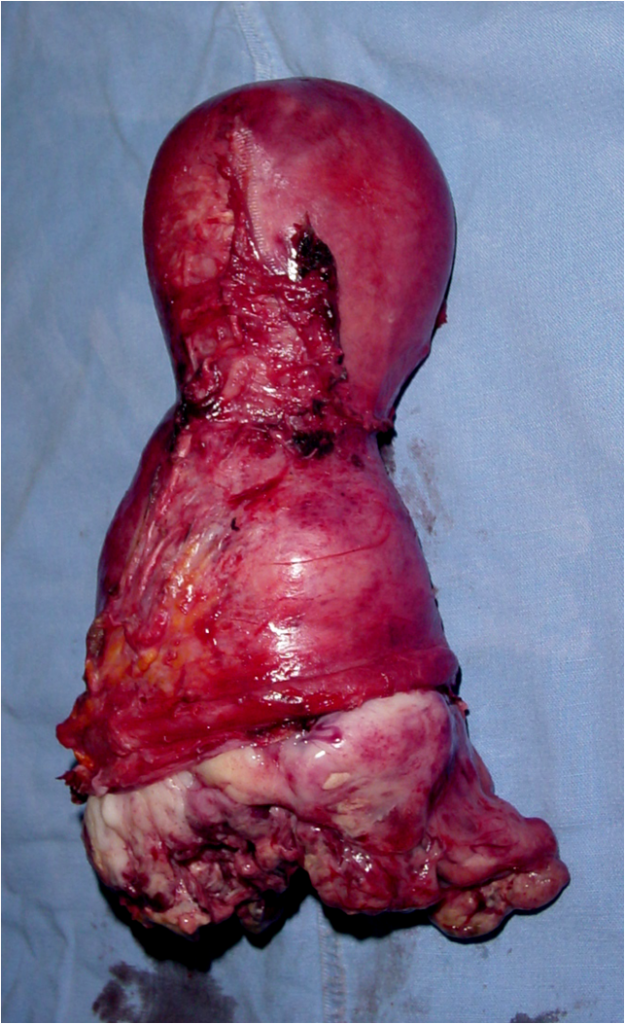
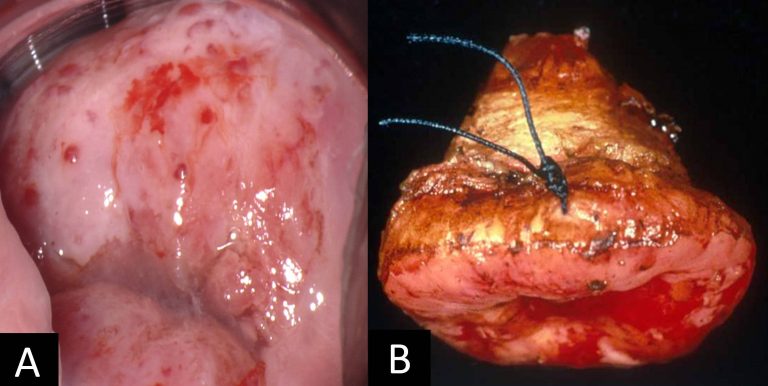
En los estadios avanzados, las pacientes pueden presentar cansancio por anemia intensa, uropatia obstructiva, edema de las extremidades inferiores, hematuria, obstrucción intestinal y caquexia (Figura 18, Figura 19).En la mayoría de las mujeres, la exploración vaginal con especulo revela una masa proliferativa ulcerada. También pueden presentarse síntomas relacionados con el sistema digestivo bajo y urinario secundarios ya sea a compresión o a infiltración de los mismos como poliaquiuria, estreñimiento o fístula urinaria o rectal o ambas (Figura 20).
Diagnóstico
El diagnóstico de las lesiones preinvasoras y de las lesiones invasoras iniciales se realiza mediante citología y colposcopia. De manera habitual la presencia de una citología anormal en una paciente con un examen físico normal es indicativa para la realización de colposcopia (Figura 5.21). Los hallazgos colposcópicos sugestivos de lesión invasora son: epitelio acetoblanco denso, la presencia de puntilleo, mosaico y vasos atípicos . Ante estos hallazgos en necesario la realización de una biopsia para la confirmación diagnóstica (Figura 5.22).
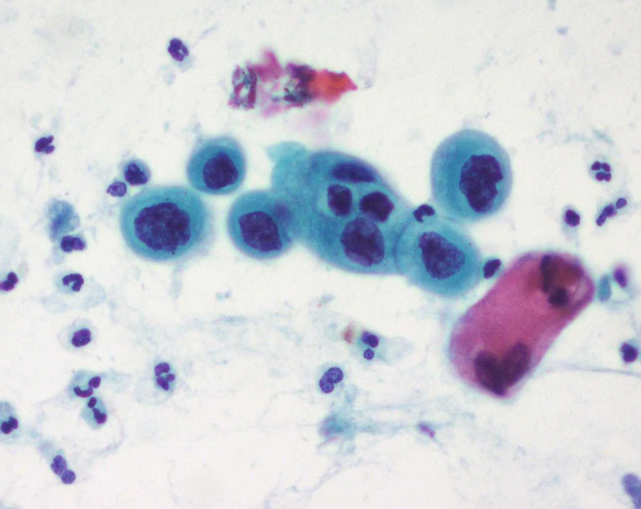

La historia clínica es esencial como en cualquier patología, poniendo especial interés en los factores de riesgo antes mencionados, así como en síntomas relacionados como la pérdida ponderal y las manifestaciones de anemia. La exploración física deberá incluir el examen ginecológico tanto vaginal como rectal, así como la especuloscopia (Figura 5.23). También es importante realizar énfasis en la palpación del borde hepático y de áreas linfoportadoras como son la ingle y el hueco supraclavicular para descartar enfermedad metastásica. Si durante la exploración física se encuentra una lesión macroscópica a nivel del cérvix es necesario realizar una biopsia y no una citología ya que en estas situaciones la citología produce resultados erróneos (falsos negativos) en hasta un 50% de los casos. De igual manera deberá realizarse biopsia por aspiración de los ganglios sospechosos.
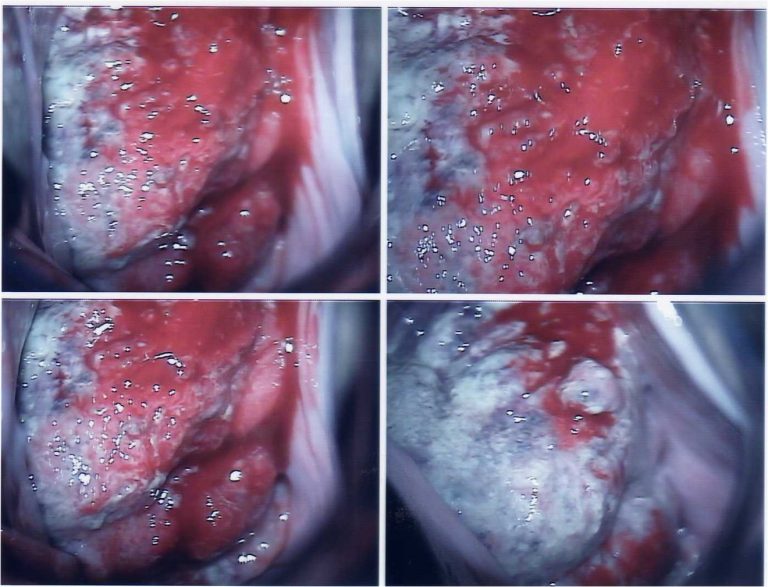
En caso de sospecha o confirmación de cáncer o carcinoma, la paciente debe ser referida a un Centro Oncológico, para recibir el tratamiento adecuado.
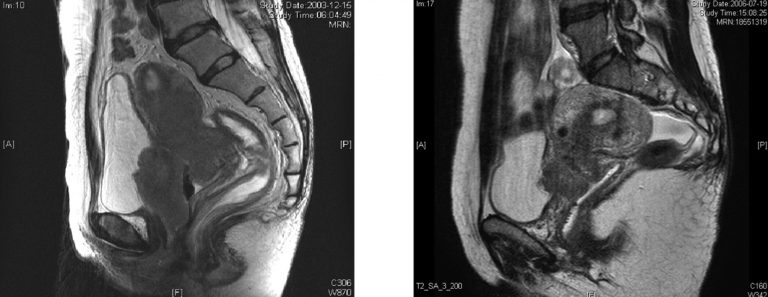
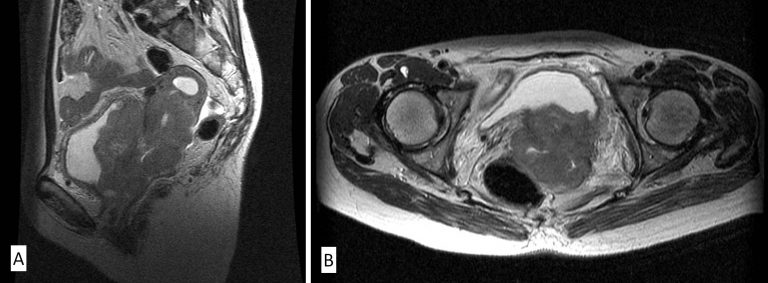
Los estudios de laboratorio y de gabinete se encuentran encaminados a identificar el estado del paciente así como para descartar enfermedad extrapélvica. Normalmente se solicita biometría hemática y química sanguínea para valorar su estado hematológico y la función renal respectivamente. En cuanto a los estudios de gabinete se solicita a todas las pacientes una tele de tórax. A las pacientes con una etapa clínica IB2 o mayor se les solicitará una TAC abdominopélvica o Resonancia magnética(Figura 24, Figura 25) para evaluar el estado de los ganglios pélvicos y retroperitoneales y del hígado. En pacientes con neoplasias en etapa clínica IIIB deberá realizarse además cistoscopía y rectoscopía para descartar invasión a estos órganos, así como urografía excretora.
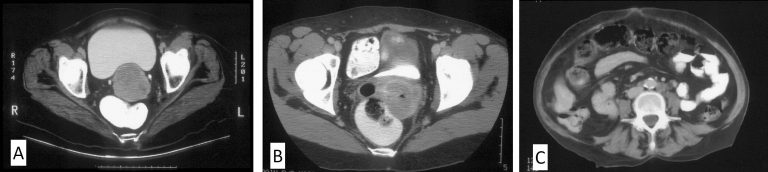
B. TAC Abdomen-pelvis. Cáncer cervicouterino etapa clínica IIB, tumor que invade los parametrios. C. TAC Abdomen, cáncer cervicouterino etapa clínica IVB, metástasis ganglionares paraórticas.
Estadificación
La estadificación habitualmente es clínica y se encuentra complementada con los estudios de gabinete antes mencionados. La clasificación que se utiliza normalmente es la de la FIGO 2009(International Federation of Gynecology and Obstetrics) y se describe a continuación.
| Tabla 5.1.Estadificación Cáncer Cervicoterino, FIGO 2009. | |
| Etapa I | Tumor confinado al cuello uterino |
| IA Tumor con invasión diagnosticada por patología (microscopía), con una profundidad máxima de 5 mm, medida desde la capa basal y extensión horizontal menor o igual a 7mm. | |
| IA1 Invasión estromal menor o igual a 3mm y extensión horizontal menor o igual a 7mm. | |
| IA2 Invasión estromal mayor de 3mm pero menor de 5mm y extensión horizontal menor o igual a 7mm. | |
| IB Tumor clínicamente visible, confinado al cérvix o etapas preclínicas mayores al estadio IA. | |
| IB1 Lesión clínicamente visible menor o igual a 4cm en su diámetro mayor. | |
| IB2 Lesión clínicamente visible mayor de 4cm en su dimensión mayor. | |
| Etapa II | Tumor que se extiende más allá del cuello uterino sin llegar a la pared pélvica o al tercio inferior de la vagina |
| IIA Tumor que invade fondos de saco vaginal sin invasión parametrial. | |
| IIA1 Tumor menor de 4cm | |
| IIA2 Tumor mayor de 4cm | |
| IIB Tumor in invasión parametrial, sin llegar a la pared pélvica. | |
| Etapa III | Tumor se extiende a la pared pélvica y/o involucra el tercio inferior de la vagina y/o causa hidronefrosis, riñón excluido o disfunción renal. |
| IIIA Tumor involucra el tercio inferior de la vagina y no se extiende a la pared pélvica. | |
| IIIB El tumor se extiende a la pared pélvica y/o causa hidronefrosis, riñón excluido o disfunción renal. | |
| Etapa IV | Tumor se extiende fuera de la pelvis o presenta involucro comprobado por biopsia de la mucosa vesical o rectal. El edema buloso no se considera enfermedad metastásica |
| IV A El tumor invade a la mucosa de la vejiga o recta y/o se extiende más allá de la pelvis verdadera | |
| IVB Metástasis a distancia | |
| *La nueva clasificación de la FIGO 2009, no incluye Etapa 0, carcinoma in situ |
Tratamiento
El tratamiento será normado de acuerdo a la etapa clínica (estadio de la enfermedad). De manera general las etapas tempranas son susceptibles de tratamiento quirúrgico y las etapas avanzadas son tratadas con radioterapia y quimioterapia concomitante.
En las etapas tempranas el tratamiento ideal es el quirúrgico.
•Etapa IA1
Para aquellas pacientes en EC IA1 pueden tratarse mediante una histerectomía extrafascial (Tipo I) (Figura 26) que es el tratamiento estándar, o si la paciente desea conservar la fertilidad puede optarse por la realización de un cono biopsia con márgenes libres de tumor y una vigilancia estrecha, como resultado se obtiene una curación del 99 al 100%
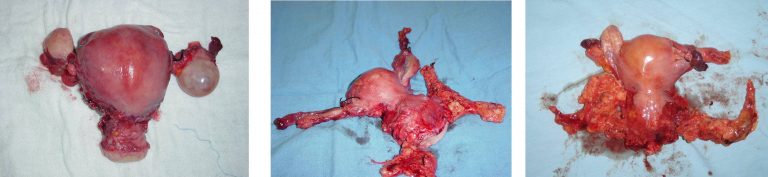
•Etapa IA2-IB1
En el caso de las pacientes con EC IA2 a IB1, se les realiza histerectomía radical tipo III el porcentaje de curación llega a ser de 85% a 90%. Las recurrencias en estas pacientes es del 10% a 25%, las cuales se presentan hasta en el 64% en los primeros 2 años, y los sitios de presentación
de recurrencias son: en la pelvis (60%); en la pelvis y a distancia (20%); y solamente a distancia (20%). En algunos centros de cáncer, se está realizando la histerectomía tipo II con los mismos resultados que la tipo III sin impactar en el porcentaje de curación, por tanto debe de considerarse
como una opción viable para el manejo de estas pacientes (Figura 26)
Existen otras opciones de manejo para estas etapas, por ejemplo, la traquelectomía radical que se reserva para pacientes con deseos de conservar su capacidad reproductiva, con tumores centrales, menores a 2 cm con histología epidermoide y sin permeación vascular linfática (PVL)
Las etapas clínicas IA2 y IB1 se tratan mediante la realización de una histerectomía radical con linfadenectomía pélvica (Figura 27) o en su defecto si la paciente no es susceptible de tratamiento quirúrgico, la opción es radioterapia a la pelvis mediante ciclo pélvico completo que incluye dos técnicas, la teleterapia y la braquiterapia o terapia intracavitaria.
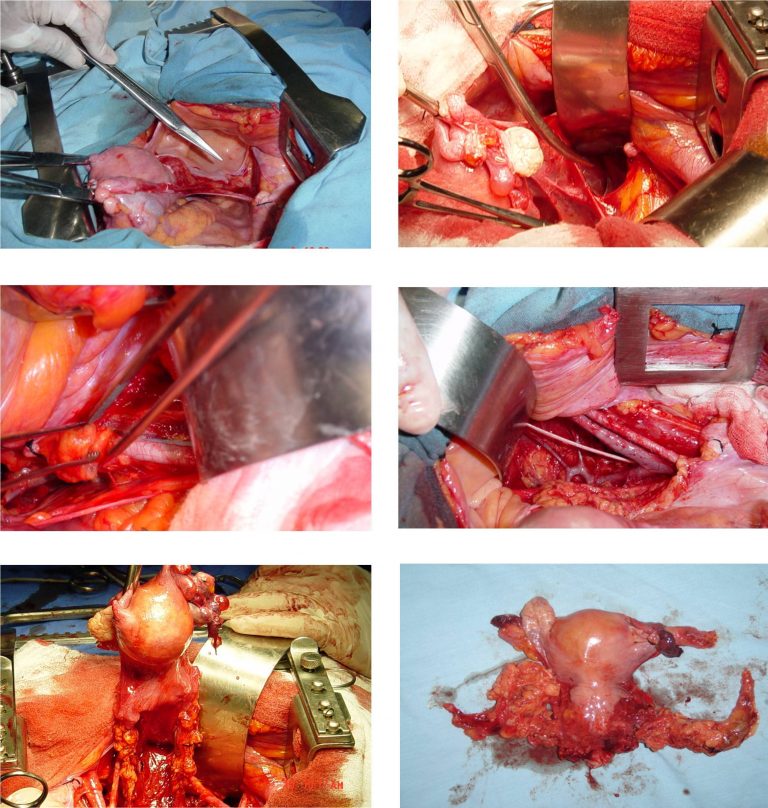
El tratamiento con radioterapia en etapas tempranas tiene el mismo porcentaje de curación que la
cirugía, pero con mayor morbilidad tanto a nivel vesical como intestinal. Las dosis empleadas son
de 75-85Gy a punto A (dependiendo del estadio), ya sea solo con braquiterapia o combinación de
radioterapia externa más braquiterapia, siendo la pérdida de la función ovárica el efecto secundario más importante en aquellas pacientes premenopáusicas, por lo que la trasposición quirúrgica de los ovarios es una alternativa para las pacientes que recibirán esta modalidad de tratamiento.
Debido a que en el 10 a 15% de pacientes tratadas inicialmente con histerectomía tipo III esta no es suficiente, se ha utilizado la radioterapia adyuvante para aquellas con factores de riesgo para recurrencia.
La radioterapia postoperatoria se reserva para aquellas pacientes en riesgo intermedio o alto. Los factores de riesgo que se consideran para recibir tratamiento adyuvante solo con radioterapia (45-50Gy a pelvis total más braquiterapia 30-35Gy en baja tasa de dosis o su equivalencia biológica en alta tasa de dosis) son tamaño del tumor >4cm, permeación vascular linfática positiva y >1/3 de invasión estromal. En caso de existir ganglios positivos, bordes quirúrgicos positivos o invasión a parametrios, se recomienda tratamiento adyuvante con radioterapia
(45-450Gy a pelvis total) y quimioterapia concomitantes mas braquiterapia (30-35Gy o su equivalente en alta tasa de dosis).
•Etapa IB2-Etapa IV
A partir de la etapa clínica IB2 en adelante todas la pacientes son tratadas con radioterapia con ciclo pélvico completo más quimioterapia concomitante. Esta última consiste en la administración de dosis semanales durante la fase de teleterapia (5 semanas) con la finalidad de radiosensibilizar al tumor, sin embargo no todas las pacientes son susceptibles de recibir quimioterapia, ya que se utiliza platino como agente radiosensibilizador el cual es nefrotóxico, por lo tanto, si la paciente no es susceptible de recibir quimioterapia solo recibirá radioterapia.
El tratamiento establecido para las etapas localmente avanzadas (Ib2 – IIa2 –IVa) es la quimio-radioterapia concomitante, siendo el cisplatino el agente radiosensiblizador mas utilizado, se ha observado que el tratamiento concomitante de cisplatino y radioterapia presenta mejores resultados tanto en control de la enfermedad con una reducción del riesgo de recurrencia
entre el 30 y 50% en comparación con radioterapia únicamente, así como una mejoría en supervivencia global de al menos 6%. El régimen más comúnmente utilizado es el de cisplatino
semanal a una dosis de 40mg/m2. Con el tratamiento concomitante de radiación y quimioterapia
basada en cisplatino, la supervivencia a 5 años se encuentra entre el 60 y 70% para los estadios
IIB a IVA y entre 70 y 76% para los estadios más tempranos IB2 y IIA. Existen otros agentes radio-sensibilizadores, tales como: el vinorelvina, que se recomienda para pacientes frágiles y geriátricos, el gemicitabine que se recomienda mayormente en pacientes con daño renal pero en buenas condiciones ya que en geriátricos y/o frágiles produce toxicidad inaceptable especialmente en mucosas y dermatológica.
En etapas localmente avanzadas, en caso de falta de control de la enfermedad, se debe considerar si es enfermedad operable, en este caso la paciente es candidata a exenteración pélvica (anterior, posterior o total) (Figura 28 y Figura 29).
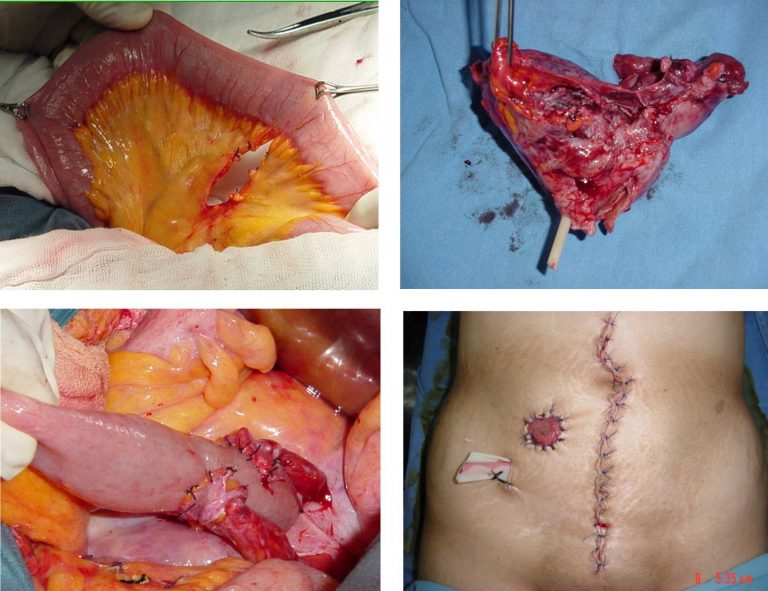

En pacientes con falta de control de la enfermedad, con recurrencia o progresión, en tumores no resecables, se debe considerar tratamiento con quimioterapia.
Es importante considerar que la paciente con cáncer cervicouterino tiene riesgo de persistencia, recurrencia o progresión de la enfermedad (según la etapa clínica inicial), en todos los casos, la valoración y conducta terapéutica se debe hacer por un grupo multidisciplinario en un centro de cáncer altamente especializado.
Prevención
La recomendación de acuerdo a la Norma Oficial Mexicana establece que deberá realizarse citología cervical de manera anual a toda paciente una vez que haya iniciado la vida sexual, en especial a las pacientes entre los 25 y los 64 años de edad, y con factores de riesgo asociados, así como a toda paciente que lo solicite. La citología se deberá reportar de acuerdo al sistema de Bethesda que engloba a la infección por virus del papiloma humano y al NIC I en lesiones intraepiteliales de bajo grado (LIEBG) y al NIC II y NIC III en lesiones intraepiteliales de alto grado (LEIAG). Las pacientes con este tipo de lesiones deberán referirse a una Clínica de Colposcopia para su evaluación y toma de biopsia en caso de ser necesario. Las mujeres con dos citologías anuales negativas se realizará la detección cada 3 años. Las mujeres con muestra citológica inadecuada para el diagnóstico, deberán ser localizadas en un lapso no mayor a 4 semanas, para repetir la prueba.
Las vacunas actuales contra el virus del papiloma humano (VPH) son vacunas profilácticas de partículas similares a virus que constan de proteínas L1 de la cápside del VPH recombinante ensambladas en partículas parecidas a las del virus que no son infecciosas ni oncógenas, producen altos niveles de anticuerpos neutralizantes. Las vacunas no tienen efecto sobre mujeres que ya hayan sido infectadas, no harán que regresen las lesiones ya establecidas. Actualmente existen dos vacunas contra VPH a) Tetravalente (frente a tipos 6,11,16,18) y b) Bivalente (contra tipos 16 y 18 de VPH). Con respecto a la vacuna, se deben consultar las recomendaciones actuales proporcionadas por los laboratorios sobre los riesgos, el costo-beneficio y las recomendaciones para grupos especiales.
La prevención secundaria se debe dirigir a la detección y tratamiento de las lesiones precursoras antes que progresen a cáncer invasor. Se deben utilizar las nuevas tecnologías como las pruebas moleculares para la detección del ADN del VPH, considerando las recomendaciones para su uso en el ámbito clínico.
El cáncer cervicouterino es una enfermedad prevenible, detectable y generalmente curable si se diagnostica en sus estadios iniciales. Se han emitido algunas estrategias para la prevención del cáncer cervicouterino en México: 1) educación para la salud, 2) vacunación contra el VPH de alto riesgo, 3) resección (en casos selectos) de la zona de transformación infectada por VPH de alto riesgo, 4) la detección, el diagnóstico y tratamiento de las lesiones preinvasoras o precursoras (lesión escamosa intraepitelial de alto grado) y 5) vigilancia epidemiológica de las mujeres tratadas.

Lecturas recomendadas
1.Torres Lobatón A, Solorza Luna G, Pimentel Ysla F. Cáncer Cervicouterino. En: Torrres-Lobatón A, editor.Cáncer Ginecológico, México:McGraw Hill; 2004, p131-168.
2. Lara-Gutierrez CA, Gutierrez-Uvalle G. Cáncer cervicoterino. En: Medina-Villaseñor EA, Martínez-Macías R, editores. Fundamentos de Oncología, 1ed. México: Universidad Nacional Autónoma de México, UNAM ;2009,p. 354-360.
3.Torres–Lobaton A, Gomez–Gutiérrez G. Piñón–Carreras RA, Torres–Rojo A. Ortiz-Leon JM, et al. Cáncer cervicouterino en el Hospital General de México, OD; frecuencia de sus etapas clínicas y su correlación con la edad. Gaceta Mexicana de Oncología GAMO 2007;6(2):28-75.
4. Secretaría de Salud. Programa de acción especifico 2007 – 2012. Cáncer cervicouterino. México: Secretaria de Salud, Centro Nacional de Equidad de Género y Salud Reproductiva; 2012. Disponible en http://www.generoysaludreproductiva.salud.gob.mx/images/stones/Programas/Cancer_cervico_uterino/Docs/110801_pae_cacu.pdf
5. Modificación a la Norma Oficial Mexicana NOM 014 SSA2-1994, Para la prevención, detección, diagnóstico, tratamiento y control del cáncer cervicouterino. México: Secretaría de Salud, 2007; 10-14
6. FIGO Committee on Gynecologic Cancer. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynecol Obstet 2009; 105: 105-106.
7. Edge SB, et al. American Joint Committee on Cancer, AJCC Cancer Staging Manual. 7a ed.New York, NY:Springer-Verlag; 2010, p.395-402.
8. Levine DA, De Los Santos J, Fleming G. Principles and Practice of Gynecologic Oncology. 5th. Philadelphia, PA: Lippincot Williams and Wilkins; 2010; p. 121-158.
9. Berek J, Hacker N. Gynecologic Oncology, 5thed. Philadelphia, PA:Lippincott Williams & Wilkins; 2010; p.341-395.
10. Tewari K, Monk BJ. Invasive Cervical Cancer. En: Disaia PJ, Creasman WT, editores. Clinical Gynecologic Oncology. 8th Edition.Philadelphia, PA:Elsevier; 2012.p51-120.
11. National Comprehensive Cancer Network (NCCN), Clinical practice guidelines in oncology, Cervical Cancer V3. 2013. Disponible en: http//:www.nccn.org.