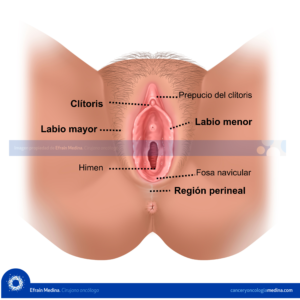
Neoplasia Intraepirelial Cervical (NIC).
Cervical Intraepithelial Neoplasia (CIN)
Definición
Las enfermedades preinvasoras del cérvix, son todas aquellas lesiones que preceden al cáncer invasor, también denominadas enfermedades o lesiones precursoras o premalignas. Se caracteriza microscópicamente por una serie de manifestaciones que incluyen diversos grados de displasia o neoplasia intraepitelial cervical (NIC o CIN, según sus siglas en inglés) antes de progresar a carcinoma invasor
Se clasifica de acuerdo a la afección del epitelio y su espesor, existen diferentes nomenclaturas para designar el daño al epitelio. (Tabla 1.1). Se especifican las equivalencias de acuerdo a la clasificación.
Se ha identificado al virus del papiloma humano (VPH), como la causa principal y necesaria para el desarrollo de la neoplasia intraepitelial cervical NIC.
Epidemiología y factores de riesgo
El VPH es la infección de transmisión sexual más común en las mujeres. El 50% de las mujeres sexualmente activas están infectadas con algún tipo(s) de VPH que pueden promover el desarrollo de cáncer. Alrededor del 79% de las mujeres sexualmente activas pueden adquirir la infección genital por VPH en toda su vida, pero la infección es habitualmente transitoria y asintomática.
Se notifica una prevalencia de 38% de infección por VPH en mujeres sanas jóvenes. Esa misma infección puede remitir con el tiempo. El pico de prevalencia de la infección por VPH en mujeres ocurre cerca de los 20 años. Después de los 20 años la prevalencia declina, aunque ocurre un segundo pico en mujeres posmenopáusicas en algunas áreas geográficas. Esto podría ser atribuido a la persistencia viral, o posiblemente nuevas adquisiciones. En México, la frecuencia de la infección por virus del papiloma humano es variable. Se ha reportado una prevalencia de estudiantes universitarios en uno y otro sexo del 14.4% con predominio en mujeres. En mexicanas adolescentes sexualmente activas con infección subclínica detectada por PCR, la frecuencia encontrada es de 20%, con incremento del riesgo a 50-60% cuando tienen o han tenido varias parejas sexuales. Se ha documentado que ha menor edad es más alta la frecuencia de ADN positivo del VPH de alto riesgo, hasta en el 60% de las mujeres de 30 años de edad y más jóvenes con una lesión escamosa intraepitelial de bajo grado (LEIBG), en comparación con el 46% de las mujeres mayores.
Los factores de riesgo, que se han documentado para cáncer cervicouterino y virus de papiloma humano son: baja escolaridad, bajo nivel socioeconómico, tabaquismo, antecedentes de enfermedades de transmisión sexual, inicio de vida sexual temprana, múltiples parejas sexuales, multiparidad y uso de anticonceptivos orales.
Se ha mencionado que existen otros determinantes de progresión a cáncer cervicouterino, entre estos se incluye: tipo viral oncogénico, persistencia de la infección, carga viral por unidad celular, factores genéticos, el sistema inmune del paciente, virus de inmunodeficiencia humana (VIH), otras enfermedades asociadas y medicamentos que causen inmunosupresión que favorezcan su degeneración.
Etiopatogenia
La infección por VPH se considera una infección frecuente entre las mujeres jóvenes, esta infección es transitoria, remite espontáneamente y en muy pocos casos progresa a casos más graves. Se ha descrito una clasificación de lesiones de alto y bajo grado, para designar las lesiones que tienen mayor riesgo de persistencia y progresión a cáncer invasor. La infección por virus del papiloma humano, puede permanecer en periodo de latencia o subclínico, tiempo durante el cual puede adquirir un estado de persistencia o regresión de las lesiones (NIC o displasia), en el peor de los casos puede progresar a cáncer invasor.
En años recientes se ha notificado la existencia de más de 100 tipos de VPH, siendo las variantes 16,18,31,33,35,39,45,51,52,56,58,59 y 68 las consideradas como de alto riesgo (AR) –o tipos carcinógenos-por encontrarse asociados al cáncer cervicouterino en más del 95% de los casos, así como a otros tumores y cáncer. Así mismo, este tipo de virus de alto riesgo se encuentran asociados a lesiones intraepiteliales cervicales de alto y bajo grado, así como a tumores o cáncer del tracto genital inferior.
Aunque existen 15 tipos que han sido clasificados como de alto riesgo, solo 8 producen la mayoría de los canceres cervicales (en orden de frecuencia): VPH 16, 18, 45, 33, 31, 52, 58 y 35.
Una minoría de infecciones por VPH de AR persisten durante 5-20 años, y estos son los verdaderos precursores del cáncer. La infección persistente por los VPH AR es un paso necesario para el desarrollo de algunos cánceres. Por otra parte, se informa que otros tipos de VPH, como el 6,11,42,43 y 44 muestran una débil asociación con cáncer cervicouterino denominándose, por tanto, tipos de bajo riesgo.
Los tipos de bajo riesgo incluyen al tipo 6 y 11 que son responsables de aproximadamente el 90% de los condilomas exofíticos en los genitales externos, vagina y cérvix, así como de muchos casos de papilomatosis respiratoria recurrente, y de menos del 15% de las lesiones cervicales de bajo grado en la zona de transformación. Las infecciones mixtas con tipos de bajo y alto riesgo son comunes en mujeres con NIC.
En relación a la etiopatogenia, se ha descrito que el virus entra en el epitelio cervical a través de microlaceraciones que ocurren frecuentemente durante el coito. En el cuello uterino, el tejido metaplásico relativamente delgado es más susceptible a la infección vírica, que el epitelio epidermoide que es más grueso y maduro. Las cuatro fases principales del desarrollo del cáncer cervical son: a) infección del epitelio metaplásico de la zona de transformación por uno o más tipos carcinógenos de VPH; b) persistencia del virus; c) progresión clonal del epitelio infectado de forma persistente hasta el precáncer cervical (NIC 3) y d) invasión.
Existen otros factores importantes en la infección por virus del papiloma humano y el desarrollo de cáncer cervical como lo son la actividad sexual, el género femenino y el inicio de vida sexual a edad temprana. Existe la asociación de cofactores que participan en la carcinogénesis del tracto genital inferior y cervical como lo son el tabaco, la infección por otros agentes microbianos, las deficiencias vitamínicas especificas, las influencias hormonales y las inmunodeficiencias.
Histología
La Neoplasia Intraepitelial Cervical (NIC) constituye una alteración de la diferenciación del epitelio escamoso del cérvix o cuello uterino, que afecta los distintos niveles de espesor y se caracteriza histológicamente por pérdida en la maduración celular, aneuploidía nuclear y figuras mitóticas anormales. Todos estos cambios están considerados como lesiones precursoras de la neoplasia invasoras del cuello uterino.
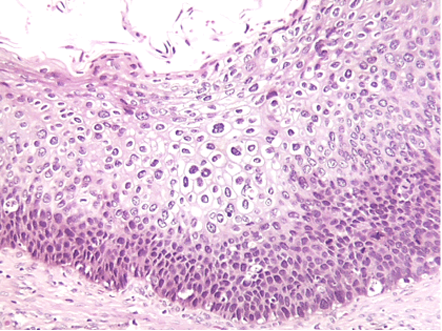
- Neoplasia Intraepitelial Cervical 1 (NIC 1): solo si afecta el tercio inferior del espesor del epitelio cervical (Figura 1.14).
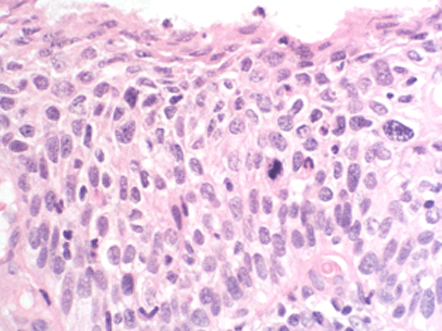
- Neoplasia Intraepitelial Cervical 2 (NIC 2): si afecta los tercios inferior y medio del epitelio (Figura 1.15).
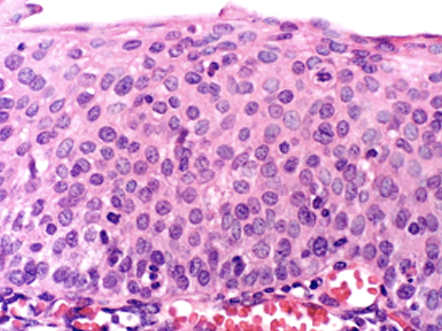
- Neoplasia Intraepitelial Cervical 3 (NIC 3): si afecta la totalidad del epitelio cervical (NIC 3 está considerado como carcinoma in situ) (Figura 1.16).
Historia Natural
Varios estudios han abordado la historia natural del NIC con un énfasis particular en la regresión, persistencia y progresión, por ejemplo para NIC 1 el 57-60% de los casos tiene regresión; solo el 32% persisten; el 10-15% progresan a NIC 3 y únicamente el 1-1.9% progresan a cáncer invasor.
Las lesiones de bajo grado (NIC1), son frecuentes en pacientes jóvenes, remiten espontáneamente y en la mayoría de los casos no requieren tratamiento.
La probabilidad de regresión en NIC 2 es del 43%; persistencia 35%; progresión a NIC 3 del 22% y probabilidad de progresión carcinoma invasor del 1.5%.
En NIC 3 se ha reportado probabilidad de regresión 32%; probabilidad de persistencia 56% y probabilidad de progresión a carcinoma invasor mayor del 12%.
La NIC 3 se considera una afección precursora de cáncer, aunque no todas las lesiones evolucionaran a cáncer cervicouterino.
El intervalo entre la infección y el diagnostico de cáncer es de 10 a 20 años.
Características clínicas
No existen síntomas específicos ni características clínicas que indiquen la presencia de NIC. Algunas pacientes se quejan de secreción transvaginal persistente y rebelde al tratamiento médico.
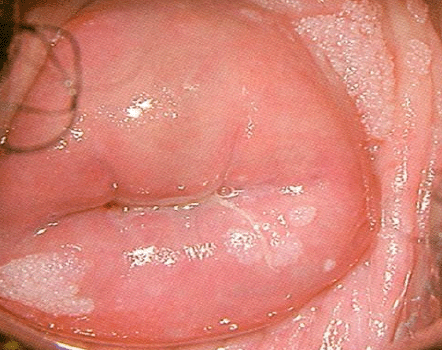
La infección por VPH es inicialmente asintomática y la transmisión ocurre antes que la expresión del virus se manifieste por signos o síntomas. La infección por VPH puede ser latente, subclínica o clínica. Cuando hay manifestaciones puede encontrarse condilomas (verrugas) genitales o lesiones intraepiteliales de bajo o alto grado. Los condilomas genitales pueden causar síntomas intensos como prurito, hemorragia e infección secundaria causada por lesiones superficiales debido al rascado (Figura 1.1). Más del 90% de las personas infectadas con virus de papiloma humano de bajo y alto grado son negativas a la infección en los siguientes 2 años. Cuando se trata de una infección latente, solo puede ser identificada por técnicas de biología molecular. En caso de una infección subclínica se puede observar por colposcopia. Muchas de estas lesiones pueden aparecer blancas tras aplicar ácido acético al 3-5% y ser yodo negativas después de aplicar lugol, pues el epitelio de la NIC contiene escaso o ningún glucógeno.
Diagnóstico:
Dentro de los estudios diagnósticos para lesiones preinvasoras de cuello uterino esta la citología cervico-vaginal comúnmente llamado Papanicolaou (Figuras 1.10 a Figura 1.13). Para la interpretación adecuada del reporte citopatológico se usan diferentes nomenclaturas, actualmente la más usada es la nomenclatura Bethesda que diferencia las lesiones en alto grado y bajo grado. Existe la Nomenclatura de Richart que divide las lesiones en NIC 1, NIC 2, NIC 3 y cáncer Invasor; la OMS la divide como displasia leve, moderada y grave, cáncer in situ y cáncer invasor; y por Papanicolaou se diferencian en clase I, clase II, III, IV y clase V. (Tabla 1.1).
En ocasiones la citología es positiva y la colposcopia es insatisfactoria o no es posible diagnosticar colposcópicamente ningún tipo de lesión, en estos casos se sugiere cepillado endocervical, prueba de ADN para el VPH e incluso conización cervical.
Dependiendo del tipo de lesión encontrada por citología, en caso de citología anormal, las pacientes se refieren a una clínica de colposcopia. La colposcopia es el examen del epitelio del cuello del útero, del tracto genital inferior y el área anogenital, usando aumento de iluminación tras la aplicación de soluciones especificas para detectar aspectos anómalos indicadores de neoplasia o para confirmar la normalidad. Parte del procedimiento se concentra en realizar biopsias de las áreas que presentan un mayor índice de anomalías.
El diagnóstico colposcópico de la neoplasia cervical requiere reconocer ciertas características: la tonalidad e intensidad del acetoblanqueo, los bordes y el contorno superficial de las zonas acetoblancas, el patrón vascular y la tinción de yodo. La colposcopia con biopsia dirigida se describe como el método de referencia o el patrón de oro para el diagnóstico de las lesiones cervicouterinas precancerosas (aunque algunos colposcopistas utilizan el criterio de “ver y tratar”). La observación de un área bien delimitada, densa, opaca, acetoblanca próxima o contigua a la unión escamoso-cilíndrica en la zona de transformación, después de la aplicación de ácido acético al 5%, es fundamental. En realidad, es el más importante de todos los signos colposcópicos y es el sello distintivo del diagnóstico colposcópico de la neoplasia cervical. El grado en que el epitelio toma la coloración acética se correlaciona con la tonalidad o la intensidad del color, el brillo superficial y la duración del efecto y, a su vez, con el grado de cambio neoplásico en la lesión (Figura 1.2). Lo más probable es que las lesiones de grado mayor adquieran una coloración blanca intensa rápidamente (Figura 1.5). Las características vasculares anormales como el punteado, (Figura 1.3, Figura 1.6), el mosaico (Figura 1.4, Figura 1.7) y los vasos atípicos (Figura 1.8 )son significativas sólo si aparecen en las zonas acetoblancas. Muchas lesiones de grado alto y bajo no contienen glucógeno y “rechazan” el yodo cuando este se aplica. Se produce un patrón de captación de color amarillo mostaza que indica la carencia de glucógeno celular(Figura 1.9)
Actualmente existe una nueva nomenclatura propuesta por la International Federation for Cervical Pathology and Colposcopy (IFCPC), que fue aceptada en el Congreso Mundial de Rio de Janeiro, Brasil 2011; por lo que deberá considerarse esta nueva terminología para los futuros reportes colposcopicos.
También, en cierto tipo de pacientes se recomiendan el uso de pruebas de ADN del VPH que ofrecen la posibilidad de reducir significativamente la incidencia de cáncer cervical. Algunos de los beneficios de la prueba del ADN del VPH incluyen el manejo de mujeres con citología de Papanicolaou con células epidermoides atípicas de significado indeterminado (ASCUS), el seguimiento tras el tratamiento a modo de prueba de curación y el cribado rutinario basado en la población de mujeres en riesgo. El uso de la prueba del virus del papiloma humano, se destaca en las guías consensuadas para el tratamiento de las mujeres con alteraciones cervicales citológicas de 2006, la última actualización es del 2012 propuesta por la American Society for Colposcopy and Cervical Pathology. La principal ventaja de la prueba del ADN de los VPH de alto riesgo es su alta sensibilidad para detectar carcinomas cervicales epidermoides y sus precursores.
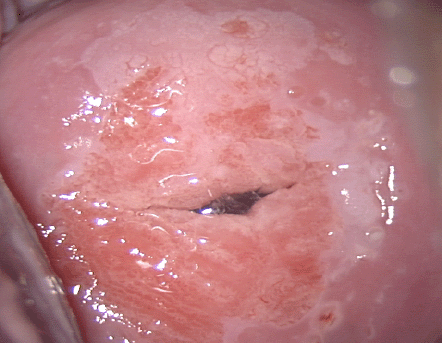
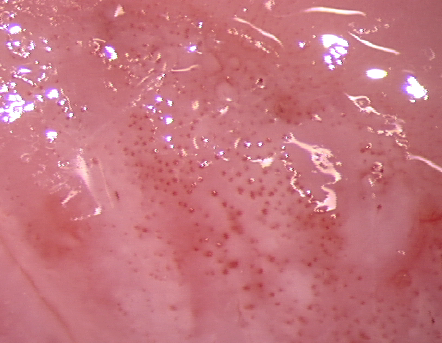
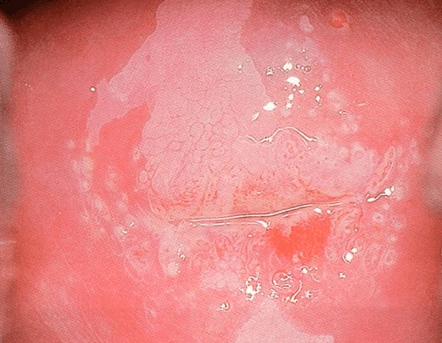
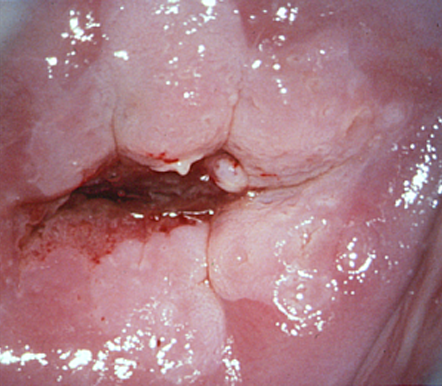
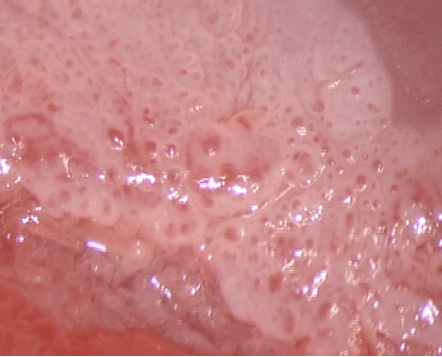
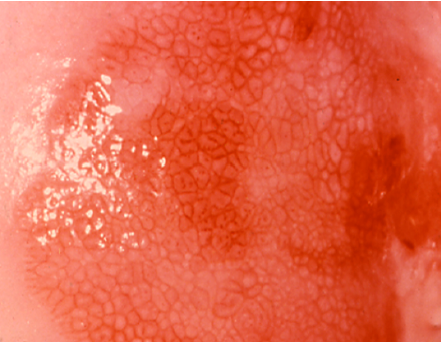
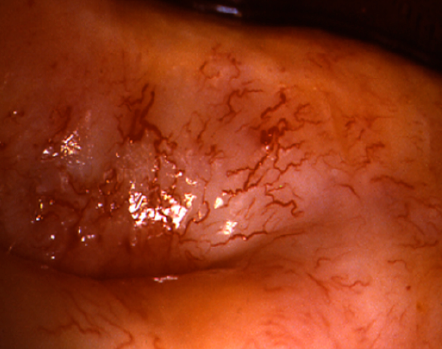
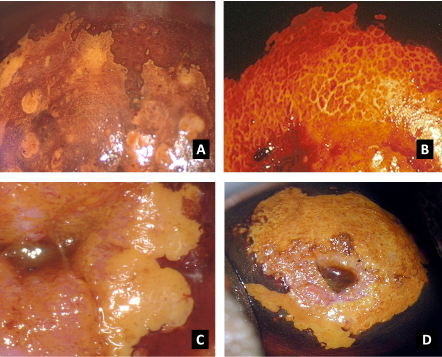
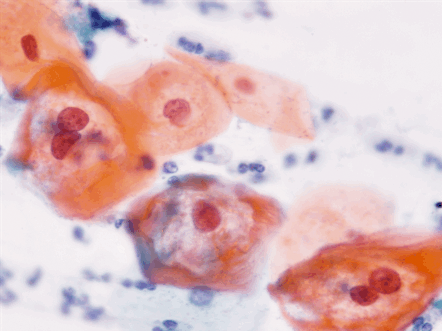
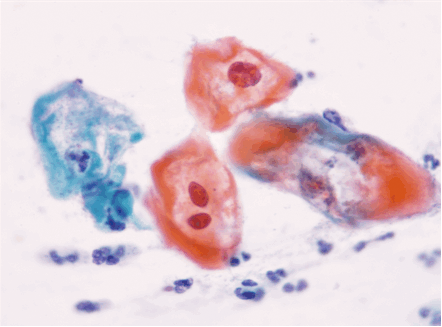
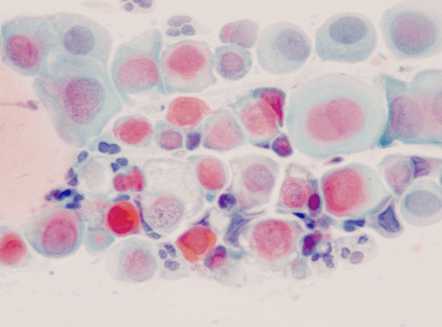
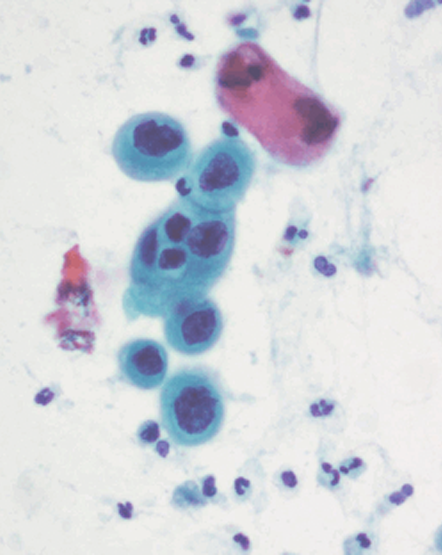
Diagnóstico diferencial
Se debe hacer diagnóstico diferencial con otras patologías que imitan lesiones de bajo grado como es el caso de la metaplasia inmadura; los hallazgos colposcópicos de reparación que pueden verse después de un tratamiento con crioterapia o procedimientos de escisión con asa; en mujeres posmenopáusicas se encuentran signos colposcópicos de atrofia y en los cambios fisiológicos de la mujer embarazada.
Se debe tener en mente que otras patologías podrían simular una lesión yodo negativa como es el caso de epitelio columnar normal, la metaplasia inmadura y la leucoplaquia que contiene poco o ninguna cantidad de glucógeno y que no reaccionan con la aplicación de lugol.
Se debe considerar el diagnostico diferencial con carcinoma microinvasor de cérvix, que puede tener características colposcópicas muy parecidas a las lesiones de alto grado.
Tratamiento
Las modalidades de tratamiento para la enfermedad cervical dependerán de acuerdo a la edad, tipo de lesión, gestación (en el caso de que la paciente curse con embarazo), inmunidad del paciente, estado postmenopáusico. Las modalidades de tratamiento son los procedimientos ablativos que incluyen la criocirugía, la diatermia para electrocoagulación y el láser CO2; y los procedimientos por escisión como la escisión electroquirúrgica con asa ( LEEP-Loop electrosurgical excision procedure), la conización cervical (escisión), la extirpación mediante láser de CO2 y la histerectomía.
Se deben consultar las guías clínicas para el tratamiento y seguimiento de las lesiones preinvasivas del cuello uterino en poblaciones especiales de mujeres con una lesión intraepitelial escamosa, como es el caso de la ASCCP-American Society for Colposcopy and Cervical Pathology en su última guía clínica del 2012.
Prevención
El cáncer cervicouterino es una enfermedad prevenible, detectable y generalmente curable si se diagnostica en sus estadios iniciales. Se han emitido algunas estrategias para la prevención del cáncer cervicouterino en México: 1) educación para la salud, 2) vacunación contra el VPH de alto riesgo, 3) resección (en casos selectos) de la zona de transformación infectada por VPH de alto riesgo, 4) la detección, el diagnóstico y tratamiento de las lesiones preinvasoras o precursoras (lesión escamosa intraepitelial de alto grado) y 5) vigilancia epidemiológica de las mujeres tratadas.
REFERENCIAS
- Cruz Talonia F, Ojeda Ortiz J, Muñoz Molina R, Gómez Gutiérrez G. Neoplasia intraepitelial cervical. En: Torres Lobatón A, Editor. Cáncer ginecológico. 1a edición. México, D.F.: Mc Graw Hill; 2003. p. 103-112.
- Modificación a la Norma Oficial Mexicana NOM 014 SSA2-1994, Para la prevención, detección, diagnóstico, tratamiento y control del cáncer cervicouterino. México: Secretaria de Salud, 2007; 10-14.
- Jiménez Becerra S. Citología. En: Medina-Villaseñor EA, Martínez- Macías R, Editores. Fundamentos de Oncología. 1a edición. México, D.F: Universidad Nacional Autónoma de México; 2009. p. 34-39.
- Solomon D, Davey DD. Kurman R, et al. The 2001 Bethesda System: Terminology for reporting of cervical cytology. JAMA 2002; 287: 2114-2119.
- Wright TC Jr. Management of women with abnormal cervical screening. En: Apgar B, Brotzman GL, Spitzer M. Editors. Colposcopy: Principles and Practices. 2nd ed. Philalphia, PA: Elsevier; 2009; p. 189-200.
- Levine DA, De Los Santos J, Fleming G. Principles and Practice of Gynecologic Oncology. 5th. Philadelphia, PA: LippincotT Williams and Wilkins; 2010; p. 53-72.
- Secretaría de Salud. Programa de acción especifico 2007 – 2012. Cáncer cervicouterino. México: Secretaria de Salud, Centro Nacional de Equidad de Género y Salud Reproductiva; 2012. Disponible en http://www.generoysaludreproductiva.salud.gob.mx/images/stones/Programas/Cancer_cervico_uterino/Docs/110801_pae_cacu.pdf
- Waxman AG. Low-Grade Squamous Intraepithelial Lesions. En: Apgar B, Brotmasn GL, Spitzer M. Editors. Colposcopy: Principles and practices. 2nd ed. Philadelphia, PA: Elsevier; 2009; p 201-224.
- Massad S. High-Grade Squamous Intraepithelial Lesions. En: Apgar B, Brotmasn GL, Spitzer M. Editors. Colposcopy: Principles and practices. 2nd ed. Philadelphia, PA: Elsevier; 2009; p 231-249.
- Borunstein J, Bentley J, Bosse P, Girardi F. et al. 2011 Colposcopy Terminology of the International Federation for Cervical Pathology and Colposcopy. Obstet Gynecol 2011; 120: 166 -172.
- Kably –Ambe A, Ruiz-Moreno JA, Lazcano-Ponce E, Vargas-Hernández VM, Aguado-Pérez RA, et al. Consenso para la prevención del cáncer cervicouterino en México. Ginecol Obstet Mex 2011; 79: 785-820
- Cox T, Ferris D, Wrigth C, et al. Management of Lower Genital Tract Neoplasia. En: Mayeaux EJ, Cox JT, Eds. Modern Colposcopy. Textbook and Atlas. 3th ed. Philadelphia, PA: Lippincot Williams and Wilkings; 2012. p.570-604.
- Massad LS, Einstein MH, Huh WK, et al. for the 2012 ASCCP Consensus Guidelines Conference. 2012 updated consensus guidelines for the managemet of abnormal cervical cancer screening test and cancer precursors. J Low Genit Tract Dis 2013; 17 (5): S1 – S27.
| Tabla 1.1. Cuadro comparativo citologías cervicales | ||||||||
| Bethesda | Negativo malignidad | Cambios reparación | ASCUS-Células escamosas atípicas de significado indeterminado
ASCH- Células de significado indeterminado y no pueden excluir LEIAG CGA- Células glandulares atípicas |
Lesión intraepitelial escamosa | Cáncer invasor | |||
| LEIBG- Lesión escamosa intraepitelial de bajo grado | LEIAG Lesión escamosa intraepitelial de alto grado | |||||||
| Richart | Normal | Inflamación | Neoplasia intraepitelial cervical | |||||
| NIC 1 | NIC 2 | NIC 3 | ||||||
| OMS | Normal | Inflamación | Displasia leve | Displasia moderada | Displasia grave | Cáncer In situ | ||
| Papanicolaou | CLASE I | CLASE II | CLASE III | CLASE IV | CLASE V | |||