INTRODUCCIÓN
Los métodos de imagen no invasivos juegan un papel fundamental y cada vez más importante en el manejo de los pacientes oncológicos. Las pruebas de imagen diagnóstica brindan información objetiva y generalmente medible sobre la actividad de la enfermedad y pueden utilizarse en diferentes momentos de la evolución de la misma, todo esto con el fin de monitorizar la eficacia del tratamiento. El uso de la imagenología en el proceso para desarrollar nuevas terapias oncológicas también va en aumento.1
Las pruebas de imagen tienen la capacidad de abarcar diferentes problemas diagnósticos que incluyen el tamizaje, caracterización de lesiones como benignas o malignas, estadificación de una neoplasia, etc. Estas pruebas son esenciales para determinar si un paciente es o no candidato a resección quirúrgica, para establecer los límites de un campo de radioterapia o para evaluar si el uso de quimioterapia sistémica está indicado. La determinación inicial por imagen del tamaño tumoral y del grado de extensión son factores pronóstico muy importantes. Durante el tratamiento, los métodos de imagen se utilizan para determinar el grado de respuesta, así como durante el seguimiento para la búsqueda de recurrencias.²
Recientemente el campo de la imagen en oncología se ha extendido a la terapéutica, generalmente como método de asistencia para la realización de procedimientos mínimamente invasivos. 2
Esta publicación tiene como objetivo hacer una revisión de la utilidad de los métodos de imagen en oncología (no invasivos e invasivos) diagnósticos y terapéuticos. La informaciónestá dirigida al médico general o de primer contacto que se enfrente al reto diagnóstico y al seguimiento del paciente oncológico.
DESARROLLO
Tamizaje
Los programas de tamizaje oncológico generalmente han tomado la forma de pruebas de laboratorio como el Papanicolaou o marcadores tumorales en sangre. El éxito del Papanicolaou en reducir las tasas de mortalidad por cáncer cervicouterino es indiscutible. El uso de métodos de imagen en el tamizaje oncológico es un ejemplo de éxito, pero también controvertido. Los programas de tamizaje con mamografía han mostrado ser capaces de salvar a mujeres mayores de 50 años. Estos programas también pueden salvar vidas en mujeres de 40 a 50 años, pero los datos son menos contundentes. Se han iniciado estudios en los que se utiliza tomografía computada (TC) de baja dosis (120 kVp, 25 mAs) como método para la detección de cáncer pulmonar en etapa temprana. El proyecto I-ELCAP (Early Lung Cancer Action Project) realiza el seguimiento de pacientes con alto riesgo para desarrollar cáncer pulmonar, en 2006 publicaron los avances de 10 años de cerca de 31,000 pacientes en todo el mundo, reportando que a los pacientes en el programa de tamizaje anual a los que se les diagnosticaba cáncer pulmonar (etapa I) tenían una tasa estimada de sobrevida a 10 años de 88%. Este estudio demostró de manera clara que la realización anual de TC de baja dosis puede detectar cáncer pulmonar en etapa temprana-curable.
Otras áreas donde el tamizaje por métodos de imagen no invasiva se ha realizado incluyen el cáncer colorrectal, donde la colonoscopía virtual puede ser utilizada para detectar cáncer de colon en etapa temprana.1
Modalidades de Imagen
Para el estudio del cáncer por imagen se cuentan con métodos anatómicos o métodos funcionales. 2, 3 Los métodos convencionales de imagen en pacientes con cáncer, y los más establecidos, son los métodos anatómicos. Actualmente ha crecido el interés en los métodos de imagen funcional para el estudio del cáncer. Existen diferentes métodos anatómicos que ofrecen información funcional que complementan la información anatómica. Las técnicas híbridas, que utilizan ambas modalidades, se están volviendo cada vez más disponibles. 4, 5.En la actualidad los datos de imagen se obtienen de manera digital o se digitalizan, haciendo el post-procesamiento y el intercambio de la información más factible.
Rayos-X
Los rayos-x convencionales siguen siendo parte importante en el estudio de pacientes con cáncer. Frecuentemente se utilizan para detectar tumores óseos y se pueden utilizar para detectar cáncer de pulmón. El método muestra principalmente densidades líquido y calcio, la imagen es afectada por la sobreposición de tejido por delante o por detrás de la lesión. Las placas de rayos-x convencionales ofrecen resolución excepcional, pero ofrecen pobre contraste. La dosis de radiación recibida depende de la parte del cuerpo que se esté examinando. 6
Tomografía Computada
Actualmente la tomografía computada (TC) está establecida como la técnica de imagen dominante para la detección y seguimiento de cáncer. Los criterios para estadificación y la evaluación de la respuesta al tratamiento se basan en las dimensiones del tumor, como se obtienen por TC. Los equipos de TC adquieren imágenes utilizando una fuente de rayos-x y detectores digitales. La fuente de los rayos-x gira alrededor del paciente, generalmente obtener un nivel de corte toma 0.5 segundos o menos.
A pesar de que este tipo de estudios proveen información clave en lo que al tamaño tumoral se refiere, algunas lesiones pueden no ser detectadas si no se aplica materia de contraste por vía intravenosa, por vía oral o por ambas. El contraste también ayuda a visualizar a las estructuras vasculares, se puede determinar si están afectadas o no, mejorando la estadificación del paciente y con esto el manejo inicial.
Una desventaja del estudio es su costo y el que utiliza radiación ionizante para la obtención de las imágenes. A pesar de ser una técnica excepcional, la información obtenida es solo anatómica. 7
Ultrasonido
El ultrasonido (US) utiliza ondas acústicas de alta frecuencia y no radiación ionizante para la obtención de imágenes. El US aporta información en alta resolución y, hasta cierto punto, información funcional, específicamente sobre la presencia y dirección del flujo sanguíneo en los tejidos. Provee información sobre las propiedades que caracterizan a los tejidos y es muy efectivo para determinar si un tejido es sólido o quístico. El método es excelente para detectar estructuras vasculares y definir la extensión del flujo. Tiene la capacidad de crear imágenes en tiempo real, de gran utilidad para la guía de biopsias y procedimientos invasivos. Su limitante principal es la pobre resolución obtenida para evaluar estructuras profundas y es operador dependiente. El US se usa frecuentemente en evaluaciones de la pelvis, cuello, hígado y vías biliares.
Actualmente se trabaja en el desarrollo de agentes que acentúan la visualización de vasos o que pueden acumularse de manera específica en trombos, con esto el US aportaría información funcional agregada a la información anatómica. 8
El US sumado a la biopsia por aspiración con aguja fina (BAAF), permite la realización de procedimientos mínimamente invasivos para la caracterización de estructuras específicas en situaciones específicas (metástasis ganglionares, nódulos tiroideos). 9
Resonancia Magnética
La Resonancia Magnética (RM) es un método de imagen anatómica que no utiliza radiación ionizante. Ofrece una resolución de contraste entre tejidos extraordinaria y una resolución espacial excelente. Una ventaja muy importante de este método es que también ofrece una variedad de formas de imagen funcional. Las imágenes por RM pueden ser de una variedad de secuencias de pulso diferentes, esto permite la visualización de diversos parámetros.También se utiliza con frecuencia la visualización de la sangre, especialmente con materiales de contraste como gadolinio, y de alteraciones en la permeabilidad vascular. 10 La RM es el estudio de elección en la evaluación de neoplasias cerebrales y de la médula espinal, así como tumores musculoesqueléticos. La RM también es de utilidad en la localización de tumores mamarios con la utilización de gadolinio y probablemente sea el método más certero para la detección y caracterización de masas en la mama.
La RM puede caracterizar los tejidos muestreando su espectro magnético por medio de la espectroscopia. La capacidad de poder detectar alto contenido de Colina (generalmente aumentada en procesos tumorales) comparativamente con otros metabolitos es de utilidad para distinguir tejido tumoral del que no lo es. La espectroscopía también aporta información sobre la concentración de Lactato y otros parámetros. Una limitante de la espectroscopía es la resolución. 11
La difusión por RM se ha mostrado prometedora en la determinación de la respuesta al tratamiento. Depende del movimiento libre de los núcleos en áreas de necrosis comparándolo con el movimiento en tejidos sanos. 12
Medicina Nuclear
Los métodos de imagen con radionúclidos aportan información funcional, sin embargo la resolución anatómica es limitada. De manera sencilla, los trazadores se pueden considerar como isótopos de fotón-único o isótopos emisores de positrones. Los emisores de fotón único típicamente tienen una vida media más larga que los emisores de positrones, y decaen de manera diferente, emitiendo rayos gamma. Gran variedad de procesos, pueden ser evaluados dependiendo del ligando unido al isótopo radioactivo. Para imágenes con isótopos de fotón único, el isótopo más común es el 99mTc, puede ser utilizado para imágenes de hueso (rastreo óseo con 99mTc-difosfonatos) o tiroides (pertecnetato de tecnecio). Para los emisores de positrones, el trazador más utilizado en el F18, utilizado como marcador del FDG, un agente que crea imágenes de glicólisis in vivo. La gran mayoría de los tumores tienen incrementado el metabolismo glucolitico, por lo tanto, el uso de este agente va en aumento, especialmente para tumores de pulmón, colorectales y linfoma. 13
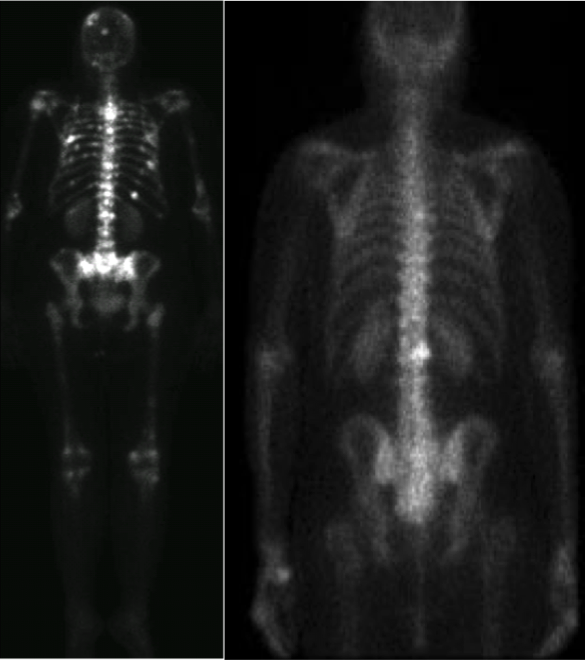
Tomografía por Emisión de Positrones
La tomografía por emisión de positrones (PET) es una técnica funcional de diagnóstico por imagen, la cual tiene la capacidad de medir la distribución in vivo de una variedad de radiofármacos. La habilidad del PET para estudiar diferentes procesos biológicos (glucosa, aminoácidos, fosfolípidos, receptores, etc.) brinda nuevas posibilidades en la práctica clínica diaria y en la investigación oncológica.
Los equipos híbridos PET/CT, a los cuales se les ha agregado el componente de tomografía computada (CT), han obtenido mejores valores de sensibilidad y especificidad que con cualquiera de las dos modalidades de manera independiente, esto es gracias a que el abordaje combinado tiene la habilidad de demostrar detalles anatómicos y funcionales en un solo estudio.
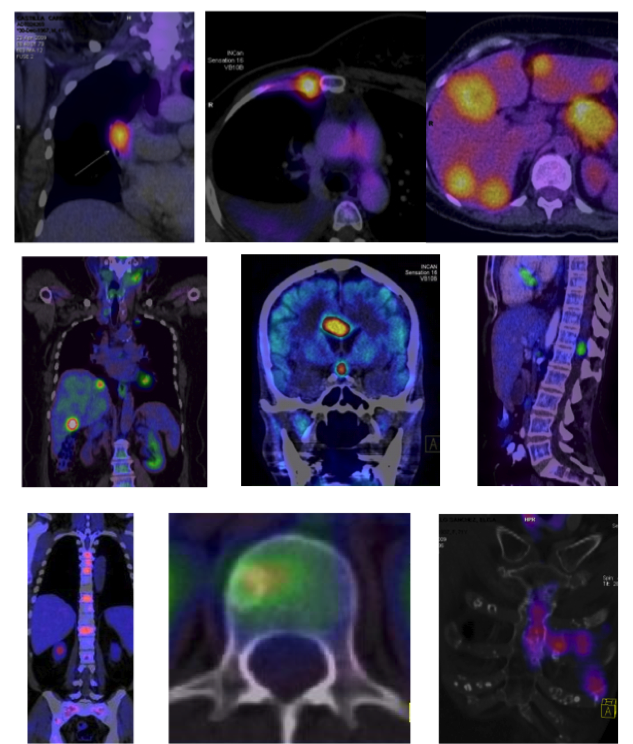
Los objetivos principales de cualquier método de diagnóstico por imagen en oncología son la detección, caracterización, determinación del grado de extensión tumoral, determinar la estadificación inicial, determinación de respuesta al tratamiento y detección de recurrencias (14). Actualmente el radiofármaco PET más utilizado con este fin es un análogo de la glucosa, en la que se ha sustituido el grupo hidroxilo del Carbono 2 por un átomo de 18F, denominado 2-[18F]fluoro-2-desoxi-D-glucosa (18FDG). 15.
La captación de la 18FDG es mediada por una familia de proteínas transportadoras (receptores GLUT), presentes en la membrana celular. 16 En el interior celular la 18FDG es fosforilada por la enzima hexoquinasa, el derivado fosforilado (18F-FDG-6P) sufre atrapamiento metabólico por no ser un sustrato adecuado para la fosfoglucosa isomerasa por carecer del – OH en el carbono 2. 17-19 El grado de captación de la 18FDG a nivel celular es directamente proporcional al metabolismo glicolítico en ellas, debido a que el metabolismo glicolítico esta incrementado de manera importante en las células tumorales, en general las imágenes PET/CT demuestran mayor grado de captación en las células malignas en relación a las células normales. Sin embargo, tasas aumentadas de captación de la 18FDG no son específicas de cáncer, se ha descrito captación incrementada en lesiones de tipo inflamatorio o infeccioso. 20, 21
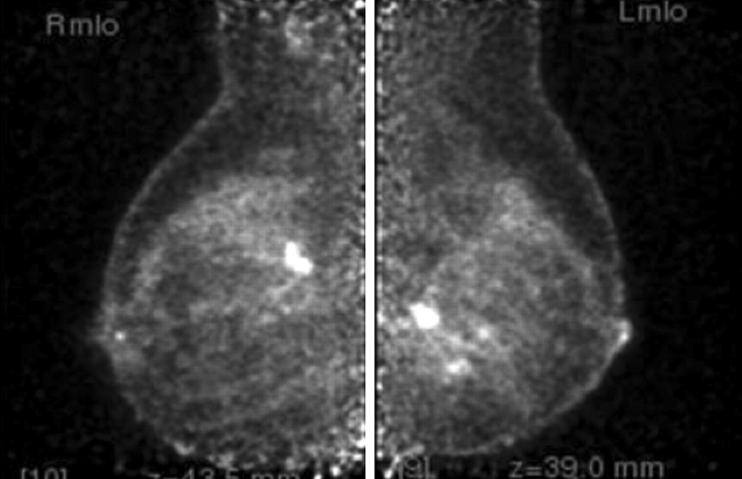
Mamografía por Emisión de Positrones
En 1993 Christopher J. Thompson, desarrolló un sistema PET de alta resolución dedicado para el estudio de la glándula mamaria, este sistema se denomina PEM (Positron EmissionMammography) o Mamografía por Emisión de Positrones, diseñado para obtener imágenes de alta resolución espacial (1.5 mm). 22-24
El PEM se utiliza como herramienta suplementaria de tamizaje, para la planificación de tratamiento, en pacientes con mamas densas, implantes mamarios, tamizaje en mujeres de alto riesgo, pacientes que no pueden someterse a una resonancia magnética (RM), planeación prequirúrgica y estadificación, monitorización de la respuesta temprana a esquemas de radioterapia y/o quimioterapia, detección de recurrencia local, evaluación de la extensión del carcinoma ductal in situ (CDIS) y de la respuesta a la quimioterapia neoadyuvante, así como auxiliar en la toma de biopsia guiada. 22, 23, 25, 26
Esta tecnología no intenta remplazar a la mamografía convencional como herramienta de tamizaje, su utilidad principal es como método de imagen complementario. 27
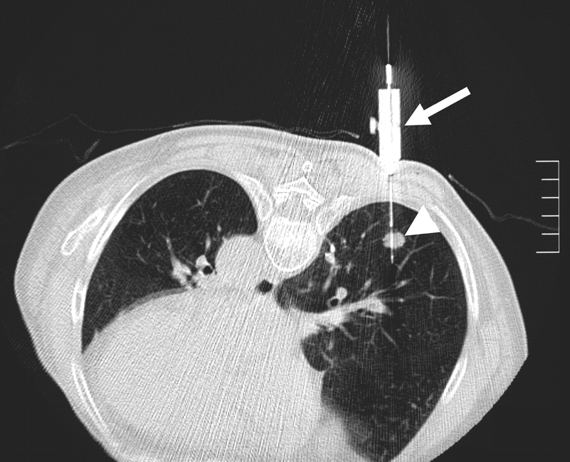
Métodos invasivos diagnósticos.
Biopsias percutáneas
Es el procedimiento de biopsia menos invasivo. Se indica para establecer diagnósticos de malignidad o benignidad, así como también obtener material para cultivo u otros estudios de laboratorio. Cada vez se utiliza más la técnica de biopsia guiada por imagen en lugar de la técnica de biopsia guiada por palpación o técnica a ciegas. 28 (28).
Los métodos de imagen utilizados pueden ser el ultrasonido que es la modalidad preferida para una biopsia en muchos institutos, en especial en lesiones móviles y en aquellas en la que se requieren múltiples ángulos de imagen. La tomografía computada se utiliza cuando los pacientes no son candidatos para realizar ultrasonido (ejemplo, pacientes post operados con cicatrices resultantes), en las lesiones más profundas en las que pueden ser obstaculizadas por el gas intestinal y en casos en que es necesario el contraste intravenoso para visualizar la lesión en cuestión y las estructuras vasculares circundantes. 28
Se pueden realizar biopsias percutáneas de distintos órganos como son pulmón, mediastino, pleura, lesiones de cabeza y cuello, adenopatías o masas retroperitoneales e intraabdominales, hígado, páncreas, masas pélvicas, carcinomatosis entre otras.
Biopsias de lesiones pélvicas ginecológicas guiadas por ultrasonido
Utilizando un transductor endocavitario con aguja guiada, las lesiones cervicales, de cúpula vaginal, parametrio y anexos son fácilmente accesibles. Las principales indicaciones para biopsia endocavitaria guiada por ultrasonido de tumoraciones pélvicas son: tumor pélvico inoperable y verificación histológica de enfermedad recurrente. Trabajos recientes han demostrado ventajas del ultrasonido transrectal (USTR) sobre el ultrasonido endovaginal(USTV) para la realización de biopsias guiadas. Se ha reportado que es posible biopsiarlesiones de hasta 5 mm. 29 (29).
Biopsias de próstata guiadas por ultrasonido transrectal
La biopsia prostática guiada por ultrasonido transrectal (USTR) es el método más aceptado para el diagnóstico de cáncer prostático. Las indicaciones incluyen un examen rectal digital (ERD) anormal o niveles de antígeno prostático especifico (APE) elevados. Históricamente se había establecido como anormal los niveles de APE mayores de 4ng/dl, pero estudios actuales han demostrado que ningún nivel del APS es el mejor indicador para biopsia prostática. 30-34(30-34).
Métodos invasivos Terapéuticas. No vasculares.
Drenaje percutáneo de abscesos
Se realiza principalmente en colecciones liquidas en abdomen y pelvis. Indicado cuando se sospecha de infección de la colección, la caracterización del fluido o en colecciones que se sospecha que producen síntomas. Se puede realizar con guía tomográfica o ultrasonográfica.35 (35).
Drenaje de derrame pleural y empiemas
El ultrasonido es el método de imagen más utilizado, pero también puede realizarse con fluoroscopia y tomografía computada. Se coloca un catéter en caso de empiema, abscesos pulmonares o derrame pleural maligno recurrente utilizando la misma técnica que en los abscesos abdominales. Últimamente se ha demostrado utilidad complementando el drenaje con terapia fibrinolítica intracavitaria, disminuyendo la viscosidad del fluido de la colección, por lo que, su eliminación teóricamente sería más fácil. 36 (36).
|
Cuadro 1. Utilidad de los métodos de Imagen en Oncología |
|
• Tamizaje
|
|
• Caracterización de la lesión: benigno o maligna, tamaño, invasión local
|
|
• Estadificación tumoral: loco-regional, sistémica, al momento de presentación o en la re-estadificación
|
|
• Tamaño y extensión tumoral: para planeación de radioterapia u otra terapia local
|
|
• Información pronostica
|
|
• Definir sitios de biopsia
|
|
• Guía para procedimientos terapéuticos invasivos
|
|
• determinación de la respuesta al tratamiento
|
|
• Re-estadificación después de tratamiento
|
|
• Determinación de la función orgánica normal o del estado de la misma antes, durante y después del tratamiento
|
|
• Determinación de toxicidad o complicaciones asociadas al tratamiento
|
|
Cuadro 2 – Modalidades de Imagen |
||||
|
Modalidad |
Resolución |
Sensibilidad |
Especificidad |
Aporte de información Funcional |
|
RM |
1–2 mm |
Moderada |
Moderada |
Moderado con espectroscopia |
|
TC |
1–2 mm |
Moderada |
Moderada |
Bajo, excepto angiotomografía |
|
Rayos-X |
1–2 mm |
Baja |
Moderada |
Muy poco |
|
SPECT |
1 cm |
Alta |
Moderada |
Excelente |
|
PET |
5 mm |
Alta |
Relativamente alta |
Excelente |
|
US |
2 mm |
Baja |
Baja |
Relativo |
|
Mamografía |
1–2 mm |
Moderada |
Relativamente baja |
Ninguno |
Bragg DG, Rubin P, Hricak H: Imaging strategies for oncologic diagnosis and multidisciplinary treatment. In Bragg D, Rubin P, Hricak H (eds): Oncologic Imaging, 2nd ed. Philadelphia, WB Saunders, 2002, pp 3–20.
CONCLUSIONES
Los objetivos principales de cualquier método de diagnóstico por imagen en oncología son la detección, caracterización, determinación del grado de extensión tumoral, estadificación inicial, determinación de respuesta al tratamiento y detección de recurrencias. Los métodos convencionales de imagen en pacientes con cáncer, y los más establecidos, son los métodos anatómicos. Actualmente ha crecido el interés en los métodos de imagen funcional para el estudio del cáncer. Existen diferentes métodos anatómicos que ofrecen información funcional que complementan la información anatómica. Las técnicas híbridas, que utilizan ambas modalidades, se están volviendo cada vez más disponibles y brindan nuevas posibilidades en la práctica clínica diaria y en la investigación oncológica.
REFERENCIAS
-
- Wahl RL. Imaging. En: Abeloff MD, et al. Abeloff’s Clinical Oncology. 4th ed. Philadelphia, Pa.: Churchill Livingstone Elsevier; 2008.
- Bragg DG, Rubin P, Hricak H: Imaging strategies for oncologic diagnosis and multidisciplinary treatment. En: Bragg D, Rubin P, Hricak H, ed. Oncologic Imaging, 2nd ed.. Philadelphia: WB Saunders; 2002: 3-20.
- Segura-Egea, JJ. Sensibilidad y especificidad de los métodos diagnósticos convencionales de las caries oclusal según la evidencia científica disponible. RCOE. 2002; 7(5): 491-501
- Wahl RL, Quint LE, Cieslak RD, et al: Anatometabolic tumor imaging: fusion of FDG PET with CT or MRI to localize foci of increased activity. J Nucl Med. 1993; 34: 1190–1197.
- Cohade C, Wahl RL: Applications of positron emission tomography/computed tomography image fusion in clinical positron emission tomography: clinical use, interpretation methods, diagnostic improvements. Semin Nucl Med. 2003; 33: 228-237.
- Gourtsoyiannis N, Grammatikakis J, Prassopoulos P: Role of conventional radiology in the diagnosis and staging of gastrointestinal tract neoplasms. Semin Surg Oncol 2001; 20: 91-108.
- Miles KA: Functional computed tomography in oncology. Eur J Cancer. 2002; 38: 2079-2084.
- DePriest PD, DeSimone CP: Ultrasound screening for the early detection of ovarian cancer. J ClinOncol. 2003; 21(Suppl 10): 194-199.
- Lehman CD, Isaacs C, Schnall MD, et al: Cancer yield of mammography, MR, and US in high-risk women: prospective multi-institution breast cancer screening study. Radiology. 2007; 244: 381-388.
- Laking GR, Price PM, Sculpher MJ: Assessment of the technology for functional imaging in cancer. Eur J Cancer. 2002; 38: 2194-2199.
- Kwock L, Smith JK, Castillo M, et al: Clinical applications of proton MR spectroscopy in oncology. Technol. Cancer Res Treat. 2002; 1: 17-28.
- Lee KC, Sud S, Meyer CR, et al: An imaging biomarker of early treatment response in prostate cancer that has metastasized to the bone. Cancer Res. 2007; 67: 3524-3528.
- Jerusalem G, Hustinx R, Beguin Y, Fillet G: PET scan imaging in oncology. Eur J Cancer. 2003; 39:1525-1534.
- Kumar R, Halanaik D, Malhotra A. Clinical applications of positron emission tomography-computed tomography in oncology. Indian J Cancer. 2010;47: 100-19
- Pinilla I, Gómez León N. Radiologia. 2009; 51(3): 248-60.
- Mochizuki T, Tsukamoto E, Kuge Y, Kanegae K, Zhao S, Hikosaka K, et al. FDG uptake and glucose transporter subtype expressions in experimental tumor and inflammation models. J Nucl Med. 2001;42:1551-5.
- McGowan KM, Long SD, Pekala PH. Glucose transporter gene expression: Regulation of transcription and mRNA stability. Pharmacol Ther. 1995; 66: 465-505.
- Delbeke D. Oncological applications of FDG PET imaging: Brain tumors, colorectal cancer, lymphoma, and melanoma. J Nucl Med. 1999; 40: 591-603.
- Avril N, Menzel M, Dose J, Schelling M, Weber W, Jδnicke F, et al. Glucose metabolism of breast cancer assessed by 18F-FDG PET: Histologic and immunohistochemical tissue analysis. J Nucl Med.2001; 42:9-16.
- Larson SM. Cancer or inflammation? A holy grail for nuclear medicine. J Nucl Med. 1994; 35: 1653-5.
- Konishi J, Yamazaki K, Tsukamoto E, Tamaki N, Onodera Y, Otake T, et al. Mediastinal lymph node staging by FDG-PET in patients with non-small cell lung cancer: Analysis of false-positive FDG-PET findings. Respiration. 2003; 70: 500-6.
- Zaidi H, Thompson C. Evolution and Developments in Instrumentation for Positron Emission Mammography. PET Clinic. 2009; 4: 317-27.
- Schilling K. Breast Imaging with a Positron Edge. Mammography. 2009; 32-4.
- Schilling K, Conti P, Adler L, et al. The role of positron emission mammography in breast cancerimaging and management. Radiology. 2008; 37(4): 26-36.
- Berg W, Weinberg I, Narayanan D. High-Resolution Fluorodeoxyglucose Positron Emission Tomography with Compression (¨Positron Emission Mammography¨) is Highly Accurate in Depicting Primary Breast Cancer. The Breast Journal. 2006; 12(4): 309-23.
- Tafra L, Cheng Z, Uddo J. Pilot clinical of 18F-fluorodeoxyglucose positron-emission mammography in the surgical management of breast cancer. The American Journal of Surgery. 2005; 190: 628-32.
- Murphy K, Aznar M, Thompson J. Results of Preliminary Clinical Trials of the Positron Emission Mammography System PEM-I: A Dedicated Breast Imaging System Producing Glucose Metabolic Images Using FDG. J Nucl Med. 2000; 41: 1851-58.
- Burke-Dixon, High-Yield Imaging: Interventional. Percutaneous biopsy. Saunders 2010: 384-385.
- Pacheco I, Rodríguez L: Biopsias de lesiones pélvicas guiadas por ultrasonido transrectal. Anales de Radiología México. 2011: 69-80.
- Sanoj Punnen, Robert K. Nam. Indications and timing for prostate biopsy, diagnosis of early stage prostate cancer and its definitive treatment: A clinical conundrum in the PSA era Surgical Oncology (2009) 18, 192e199.
- Catalona WJ, Smith DS, Ratliff TL, Basler JW. Detection of organ confined prostate cancer is increase through prostate specific antigen based screening. JAMA. 1994; 270(8): 948e54.
- Karakiewicz PI, Benayoun S, Kattan MW, Perrotte P,Valiquette L, Scardino PT, et al. Development and validation of a nomogram predicting the outcome of prostate biopsy based on patient age, digital rectal examination and serum prostate specific antigen. J Urol. 2005; 173(6): 1930e4.
- Hodge KK, McNeal JE, Terris MK. Random systematic versus directed ultrasound guided transrectalcore biopsies of the prostate. J Urol. 1989; 142: 71e4.
- Djavan B, Waldert M, Zlotta A, Dobronski P, Seitz C, Remzi M, et al. Safety and morbidity of first and repeat transrectal ultrasound guided prostate needle biopsies: results of a prospective European prostate cancer detection study. J Urol. 2001; 166(3): 856e60.
- Burke-Dixon, High-Yield Imaging: Interventional. Percutaneous abscess drainage. Saunders. 2010:378-380.
- Burke-Dixon, High-Yield Imaging: Interventional. Dreinage of pleural effusions and empyemas. Saunders. 2010: 495-497.
- Burke-Dixon, High-Yield Imaging: Interventional. Thermal ablation for hepatocellular carcinoma. Saunders. 2010: 442-444.
- Burke-Dixon, High-Yield Imaging: Interventional. Radiofrecuency ablation of renal tumors. Saunders.2010: 489-491.
- Giménez M, Guimarães M. Manual de técnicas Intervencionistas guiadas por imagen. Tratamiento de patología maligna del pulmón: Terapias de ablación. Ediciones Journal. 2011: 357-370.
- Burke-Dixon, High-Yield Imaging: Interventional. Vertebroplasty (interventional). Saunders. 2010:510-513.
- Burke-Dixon, High-Yield Imaging: Interventional. Percutaneous nefrostomy placement. Saunders.2010: 457-460.
- Covey AM; Palliative percutaneous drainage in malignant biliary obstruction. Part 1: indications and preprocedure evaluation. J Support Oncol. 2006; 4(6): 269-73.
- Percutaneous drainage and stenting for palliation of malignant bile duct obstruction. Source European Radiology. 2008; 18(3): 448-456.